+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-5328 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo EM reconstruction of mammalian 80S ribosome in rotated PRE state 1 | |||||||||
 マップデータ マップデータ | 80S mammalian ribosome | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | 80S ribosome / mammalian / elongation cycle / tRNA | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報SRP-dependent cotranslational protein targeting to membrane / GTP hydrolysis and joining of the 60S ribosomal subunit / Nonsense Mediated Decay (NMD) independent of the Exon Junction Complex (EJC) / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) / Formation of a pool of free 40S subunits / L13a-mediated translational silencing of Ceruloplasmin expression / ribosomal large subunit export from nucleus / cytoplasmic translation / cytosolic large ribosomal subunit / structural constituent of ribosome ...SRP-dependent cotranslational protein targeting to membrane / GTP hydrolysis and joining of the 60S ribosomal subunit / Nonsense Mediated Decay (NMD) independent of the Exon Junction Complex (EJC) / Nonsense Mediated Decay (NMD) enhanced by the Exon Junction Complex (EJC) / Formation of a pool of free 40S subunits / L13a-mediated translational silencing of Ceruloplasmin expression / ribosomal large subunit export from nucleus / cytoplasmic translation / cytosolic large ribosomal subunit / structural constituent of ribosome / RNA binding / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 10.6 Å | |||||||||
 データ登録者 データ登録者 | Budkevich T / Giesebrecht J / Altman R / Munro J / Mielke T / Nierhaus K / Blanchard S / Spahn C | |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2011 ジャーナル: Mol Cell / 年: 2011タイトル: Structure and dynamics of the mammalian ribosomal pretranslocation complex. 著者: Tatyana Budkevich / Jan Giesebrecht / Roger B Altman / James B Munro / Thorsten Mielke / Knud H Nierhaus / Scott C Blanchard / Christian M T Spahn /  要旨: Although the structural core of the ribosome is conserved in all kingdoms of life, eukaryotic ribosomes are significantly larger and more complex than their bacterial counterparts. The extent to ...Although the structural core of the ribosome is conserved in all kingdoms of life, eukaryotic ribosomes are significantly larger and more complex than their bacterial counterparts. The extent to which these differences influence the molecular mechanism of translation remains elusive. Multiparticle cryo-electron microscopy and single-molecule FRET investigations of the mammalian pretranslocation complex reveal spontaneous, large-scale conformational changes, including an intersubunit rotation of the ribosomal subunits. Through structurally related processes, tRNA substrates oscillate between classical and at least two distinct hybrid configurations facilitated by localized changes in their L-shaped fold. Hybrid states are favored within the mammalian complex. However, classical tRNA positions can be restored by tRNA binding to the E site or by the eukaryotic-specific antibiotic and translocation inhibitor cycloheximide. These findings reveal critical distinctions in the structural and energetic features of bacterial and mammalian ribosomes, providing a mechanistic basis for divergent translation regulation strategies and species-specific antibiotic action. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_5328.map.gz emd_5328.map.gz | 1008.2 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-5328-v30.xml emd-5328-v30.xml emd-5328.xml emd-5328.xml | 10.1 KB 10.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_5328_1.jpg emd_5328_1.jpg | 105.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-5328 http://ftp.pdbj.org/pub/emdb/structures/EMD-5328 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5328 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5328 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_5328_validation.pdf.gz emd_5328_validation.pdf.gz | 317.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_5328_full_validation.pdf.gz emd_5328_full_validation.pdf.gz | 317 KB | 表示 | |
| XML形式データ |  emd_5328_validation.xml.gz emd_5328_validation.xml.gz | 6.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5328 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5328 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5328 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5328 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_5328.map.gz / 形式: CCP4 / 大きさ: 21.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_5328.map.gz / 形式: CCP4 / 大きさ: 21.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 80S mammalian ribosome | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.52 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
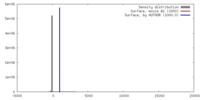
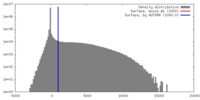
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : 80S-PRE-rotated-1 complex from rabbit (Oryctolagus cuniculus) liver
| 全体 | 名称: 80S-PRE-rotated-1 complex from rabbit (Oryctolagus cuniculus) liver |
|---|---|
| 要素 |
|
-超分子 #1000: 80S-PRE-rotated-1 complex from rabbit (Oryctolagus cuniculus) liver
| 超分子 | 名称: 80S-PRE-rotated-1 complex from rabbit (Oryctolagus cuniculus) liver タイプ: sample / ID: 1000 / 詳細: Sample was re-associated from subunits / 集合状態: monomer / Number unique components: 5 |
|---|---|
| 分子量 | 実験値: 4 MDa / 手法: Sedimentation |
-超分子 #1: 80S ribosome
| 超分子 | 名称: 80S ribosome / タイプ: complex / ID: 1 / 組換発現: No / データベース: NCBI / Ribosome-details: ribosome-eukaryote: LSU 60S, SSU 40S |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 4 MDa |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | 詳細: Quantifoil grids |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 77 K / 装置: OTHER / 詳細: Vitrification instrument: VitroBot (FEI) 手法: Flash-frozen in liquid ethane on carbon coated Quantifoil grids |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 温度 | 平均: 77 K |
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 200,000 times magnification |
| 日付 | 2006年10月17日 |
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: PRIMESCAN / デジタル化 - サンプリング間隔: 4.7 µm / 実像数: 87 / 平均電子線量: 20 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 65520 / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 2 mm / 最大 デフォーカス(公称値): 4.0 µm / 最小 デフォーカス(公称値): 2.0 µm / 倍率(公称値): 39000 |
| 試料ステージ | 試料ホルダー: Cartridge / 試料ホルダーモデル: GATAN HELIUM |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
- 画像解析
画像解析
| CTF補正 | 詳細: By defocus groups |
|---|---|
| 最終 再構成 | アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 10.6 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: SPIDER 詳細: Several rounds of multireference 3D projection refinement 使用した粒子像数: 22212 |
 ムービー
ムービー コントローラー
コントローラー


























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)