+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4595 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | T=4 quasi-symmetric bacterial microcompartment particle | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | bacterial microcompartment / protein shell / GRM2 type microcompartment / EutN / ccmK / PduA / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Klebsiella pneumoniae (肺炎桿菌) Klebsiella pneumoniae (肺炎桿菌) | |||||||||
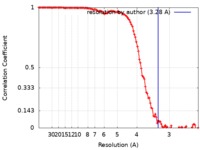
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.28 Å | |||||||||
 データ登録者 データ登録者 | Kalnins G | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2020 ジャーナル: Nat Commun / 年: 2020タイトル: Encapsulation mechanisms and structural studies of GRM2 bacterial microcompartment particles. 著者: Gints Kalnins / Eva-Emilija Cesle / Juris Jansons / Janis Liepins / Anatolij Filimonenko / Kaspars Tars /   要旨: Bacterial microcompartments (BMCs) are prokaryotic organelles consisting of a protein shell and an encapsulated enzymatic core. BMCs are involved in several biochemical processes, such as choline, ...Bacterial microcompartments (BMCs) are prokaryotic organelles consisting of a protein shell and an encapsulated enzymatic core. BMCs are involved in several biochemical processes, such as choline, glycerol and ethanolamine degradation and carbon fixation. Since non-native enzymes can also be encapsulated in BMCs, an improved understanding of BMC shell assembly and encapsulation processes could be useful for synthetic biology applications. Here we report the isolation and recombinant expression of BMC structural genes from the Klebsiella pneumoniae GRM2 locus, the investigation of mechanisms behind encapsulation of the core enzymes, and the characterization of shell particles by cryo-EM. We conclude that the enzymatic core is encapsulated in a hierarchical manner and that the CutC choline lyase may play a secondary role as an adaptor protein. We also present a cryo-EM structure of a pT = 4 quasi-symmetric icosahedral shell particle at 3.3 Å resolution, and demonstrate variability among the minor shell forms. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4595.map.gz emd_4595.map.gz | 115.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4595-v30.xml emd-4595-v30.xml emd-4595.xml emd-4595.xml | 19.3 KB 19.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_4595_fsc.xml emd_4595_fsc.xml | 13.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_4595.png emd_4595.png | 115.5 KB | ||
| Filedesc metadata |  emd-4595.cif.gz emd-4595.cif.gz | 6.1 KB | ||
| その他 |  emd_4595_half_map_1.map.gz emd_4595_half_map_1.map.gz emd_4595_half_map_2.map.gz emd_4595_half_map_2.map.gz | 95.7 MB 95.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4595 http://ftp.pdbj.org/pub/emdb/structures/EMD-4595 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4595 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4595 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_4595_validation.pdf.gz emd_4595_validation.pdf.gz | 458.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_4595_full_validation.pdf.gz emd_4595_full_validation.pdf.gz | 457.6 KB | 表示 | |
| XML形式データ |  emd_4595_validation.xml.gz emd_4595_validation.xml.gz | 17.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4595 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4595 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4595 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4595 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4595.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4595.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.23 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: #1
| ファイル | emd_4595_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
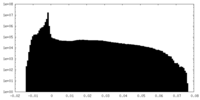
| 投影像・断面図 |
| ||||||||||||
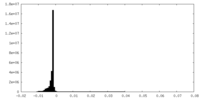
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_4595_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
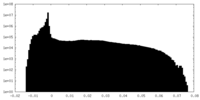
| 投影像・断面図 |
| ||||||||||||
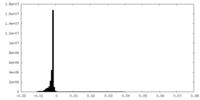
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : T=4 quasi-symmetric bacterial microcompartment particle
| 全体 | 名称: T=4 quasi-symmetric bacterial microcompartment particle |
|---|---|
| 要素 |
|
-超分子 #1: T=4 quasi-symmetric bacterial microcompartment particle
| 超分子 | 名称: T=4 quasi-symmetric bacterial microcompartment particle タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Bacterial microcompartment particle made by coexpression of shell proteins |
|---|---|
| 由来(天然) | 生物種:  Klebsiella pneumoniae (肺炎桿菌) Klebsiella pneumoniae (肺炎桿菌) |
| 分子量 | 理論値: 2.45 MDa |
-分子 #1: Carbon dioxide concentrating mechanism protein CcmL
| 分子 | 名称: Carbon dioxide concentrating mechanism protein CcmL / タイプ: protein_or_peptide / ID: 1 / コピー数: 60 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Klebsiella pneumoniae (肺炎桿菌) Klebsiella pneumoniae (肺炎桿菌) |
| 分子量 | 理論値: 9.962463 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MILAKVTGHV VATQKCDELR GSNLLLITRL DDKQQPMKDQ TWVAVDNVGA GMHDIVLAEE YFALNKDRYK AMSVVAIVEK VFRDTEQE UniProtKB: Carbon dioxide concentrating mechanism protein CcmL |
-分子 #2: BMC domain-containing protein
| 分子 | 名称: BMC domain-containing protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 180 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Klebsiella pneumoniae (肺炎桿菌) Klebsiella pneumoniae (肺炎桿菌) |
| 分子量 | 理論値: 10.309946 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MKEALGLIET KGLVACIEAA DAMCKAANVE LIGYENVGSG LVTAMVKGDV GAVNAAVDSG VEAAKRIGKV VSSRVIARPH NDIEKIAGS TKHKSLRPHN A UniProtKB: BMC domain-containing protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 / 構成要素:
| |||||||||
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON | |||||||||
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 291 K / 装置: FEI VITROBOT MARK IV / 詳細: blot for 4 seconds before plunging. | |||||||||
| 詳細 | Sample was purified with gel filtration |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 特殊光学系 | 位相板: VOLTA PHASE PLATE |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 実像数: 1316 / 平均露光時間: 1.0 sec. / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): -3.0 µm 最小 デフォーカス(公称値): -1.4000000000000001 µm 倍率(公称値): 120000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー



















 Z
Z Y
Y X
X