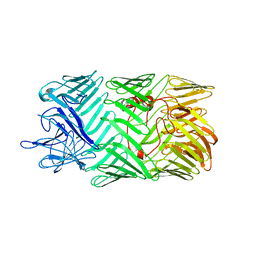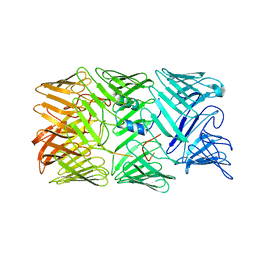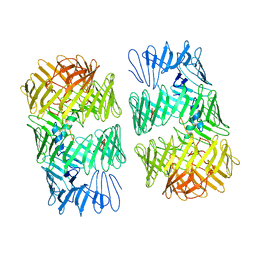+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Type VI secretion system effector RhsP in its pre-autoproteolysis and monomeric form | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | T6SS / Rhs proteins / polymorphic toxins / TOXIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報WHH domain-containing protein / A nuclease of the HNH/ENDO VII superfamily with conserved WHH / Domain of unknown function DUF6531 / RHS protein / Domain of unknown function (DUF6531) / RHS protein / RHS repeat / RHS Repeat / YD repeat / Rhs repeat-associated core / : 類似検索 - ドメイン・相同性 | |||||||||
| 生物種 |   Vibrio parahaemolyticus serotype O3:K6 (strain RIMD 2210633) (腸炎ビブリオ) Vibrio parahaemolyticus serotype O3:K6 (strain RIMD 2210633) (腸炎ビブリオ) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.16 Å | |||||||||
 データ登録者 データ登録者 | Tang L / Dong SQ / Rasheed N / Wu HW / Zhou NK / Li HD / Wang ML / Zheng J / He J / Chao WCH | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Cell Rep / 年: 2022 ジャーナル: Cell Rep / 年: 2022タイトル: Vibrio parahaemolyticus prey targeting requires autoproteolysis-triggered dimerization of the type VI secretion system effector RhsP. 著者: Tang L / Dong S / Rasheed N / Wu HW / Zhou N / Li H / Wang M / Zheng J / He J / Chao WCH | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_34541.map.gz emd_34541.map.gz | 61.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-34541-v30.xml emd-34541-v30.xml emd-34541.xml emd-34541.xml | 17.8 KB 17.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_34541.png emd_34541.png | 87.1 KB | ||
| マスクデータ |  emd_34541_msk_1.map emd_34541_msk_1.map | 65.5 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-34541.cif.gz emd-34541.cif.gz | 6.7 KB | ||
| その他 |  emd_34541_half_map_1.map.gz emd_34541_half_map_1.map.gz emd_34541_half_map_2.map.gz emd_34541_half_map_2.map.gz | 61.4 MB 61.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-34541 http://ftp.pdbj.org/pub/emdb/structures/EMD-34541 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34541 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-34541 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_34541_validation.pdf.gz emd_34541_validation.pdf.gz | 759.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_34541_full_validation.pdf.gz emd_34541_full_validation.pdf.gz | 758.9 KB | 表示 | |
| XML形式データ |  emd_34541_validation.xml.gz emd_34541_validation.xml.gz | 12.2 KB | 表示 | |
| CIF形式データ |  emd_34541_validation.cif.gz emd_34541_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34541 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34541 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34541 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-34541 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_34541.map.gz / 形式: CCP4 / 大きさ: 65.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_34541.map.gz / 形式: CCP4 / 大きさ: 65.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.87 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Type VI secretion system effector RhsP in its pre-autoproteolysis form
| 全体 | 名称: Type VI secretion system effector RhsP in its pre-autoproteolysis form |
|---|---|
| 要素 |
|
-超分子 #1: Type VI secretion system effector RhsP in its pre-autoproteolysis form
| 超分子 | 名称: Type VI secretion system effector RhsP in its pre-autoproteolysis form タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Putative Rhs-family protein
| 分子 | 名称: Putative Rhs-family protein / タイプ: protein_or_peptide / ID: 1 / 詳細: Uncleaved RhsP in its monomeric form / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Vibrio parahaemolyticus serotype O3:K6 (strain RIMD 2210633) (腸炎ビブリオ) Vibrio parahaemolyticus serotype O3:K6 (strain RIMD 2210633) (腸炎ビブリオ) |
| 分子量 | 理論値: 160.008469 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGSSHHHHHH SQDPENLYFQ SMIPQFVIPL TNCLGQSYHF SSQPIPKGEH KKFDSEQSAK AFLDDFVPLR SSRVEELYHL LGQFPPNVP DEELTPELYA PVFAKALVNG SLYVASFPKT KKNATISSEP TPVPKQVKAK SKQNKAHTSS KTQAKNSASA K PLQTGSEC ...文字列: MGSSHHHHHH SQDPENLYFQ SMIPQFVIPL TNCLGQSYHF SSQPIPKGEH KKFDSEQSAK AFLDDFVPLR SSRVEELYHL LGQFPPNVP DEELTPELYA PVFAKALVNG SLYVASFPKT KKNATISSEP TPVPKQVKAK SKQNKAHTSS KTQAKNSASA K PLQTGSEC HEKAGDPVSL VTGAEILTLN DVELPNGFVW SRTYRSSKAS RNQGLGYGWR HAFQFELKEV TDEKHNVTSW EF ISDSADE IEFEPVEHGS TSYQVYVGAS CHFLNPNIRI VTLSSGDQYR FELVEDIWLL KQVRNGIFST FQLRYSRNHR LIE VAHNKR PVLECQYDKQ GRLVELLNAK TEQVLTTYIY DEQDDLVGAT NDLGLTERYE YQDQHLIAKR VRPTGFTHYF EWSG EGSSA KCIRNFGDSG IYDYRFHYEG AKSSYSDSLD NEWTFIHDEQ GHLLEKSSPT GRTWQWHYDH LGRKEKAVFP DNSTT QYQY NQQGQLISKL HSSGAQIQYG YDSLGKLVKT VSPDGDLEKA YYNSLGQRVW DIDALGCVTE YEYDKHGQVV KRESED GKK SRWWWDKQQR LVAHEVDGTL LRYSYGATDL VNGIAYPDGC VAQISYDDYG RRTSIRYFND EDKVGYSEEY AYDEFSR VA QIQTPEGVTS YQWGALAQQE AVIFPDGSHI SYEYDQQRNL TKLVRSDGLA FEFWYDSEGL LSGTVGFDGL HSQFKYDS M GRIIRKDVAD RTVLYSYDDA GFLQHIKAGN GKNIVENHFN YTLGGRLTLA SNRHQTLQYQ YSSFGHLTKR IQGQFEIGE EFNRVGQRVS QTLPDKTSFN FSYDTNGRLS EIRFSDDSLP KIEFQYDVMG RLSVTETESF RESKLYDGVG RLVEQQWSGR EKKYIYNAQ NRISSILDNT AGATHYQYDT LGYVTKVSEA GSTSTFESDS FGNPALADSK VMSDRIEAYA GVRYKYDQQG N QVKREGDG TVQKRVFDAL SQLVEVHGDS SISHYEYDAL GRRTKKITQN GITEFLWEGE RLLGERTADG FRWYLYQPET YI PLAVLEN GSIYLYECDQ VGKPERLKDS AGNIVWSASY DVHGFASIDV EEVRNPLRFQ GQYFDQETNL HYNLARYYDP KLG RFIQQD PISIAGGINH YQYAVNPIQW IAPTGFLCEE GLKRLQQMLA EYQAQSDVPQ EVCDQILEAA KESSVGEDGV RSQV KIRKP NGKNNIRYEY DLDHIDCKKN EITFYRHINY SDGSKRKIQY TVGIEGFVDI YDFVNVQKCD AQVYDTKTSK TVGGR KIIN SEFAGKTVTT KGGDVRFDSD GFPDFTPYSK KTVRVIGLTG DMANDVPLAM ARAKITKYDK SKYVWHHHQD GKTMML IPK SVHSVRNGGV AATGGRSVIQ HNLLNPNNKL NYSSPEELV UniProtKB: Putative Rhs-family protein |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | 3D array |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー