+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3165 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Bovine mitochondrial ATP synthase state 1b | |||||||||
 マップデータ マップデータ | Reconstruction of detergent-solubilized bovine mitochondrial ATP synthase | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ATP synthase / rotary ATPase | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Mitochondrial protein import / Formation of ATP by chemiosmotic coupling / Cristae formation / mitochondrial proton-transporting ATP synthase complex assembly / mitochondrial envelope / : / : / proton-transporting ATP synthase complex / : / : ...Mitochondrial protein import / Formation of ATP by chemiosmotic coupling / Cristae formation / mitochondrial proton-transporting ATP synthase complex assembly / mitochondrial envelope / : / : / proton-transporting ATP synthase complex / : / : / : / Mitochondrial protein degradation / proton-transporting ATP synthase complex, coupling factor F(o) / proton motive force-driven ATP synthesis / proton motive force-driven mitochondrial ATP synthesis / proton transmembrane transporter activity / proton-transporting ATP synthase complex, catalytic core F(1) / H+-transporting two-sector ATPase / proton-transporting ATPase activity, rotational mechanism / proton-transporting ATP synthase activity, rotational mechanism / aerobic respiration / proton transmembrane transport / ADP binding / mitochondrial inner membrane / lipid binding / ATP hydrolysis activity / mitochondrion / ATP binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 7.4 Å | |||||||||
 データ登録者 データ登録者 | Zhou A / Rohou A / Schep DG / Bason JV / Montgomery MG / Walker JE / Grigorieff N / Rubinstein JL | |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2015 ジャーナル: Elife / 年: 2015タイトル: Structure and conformational states of the bovine mitochondrial ATP synthase by cryo-EM. 著者: Anna Zhou / Alexis Rohou / Daniel G Schep / John V Bason / Martin G Montgomery / John E Walker / Nikolaus Grigorieff / John L Rubinstein /    要旨: Adenosine triphosphate (ATP), the chemical energy currency of biology, is synthesized in eukaryotic cells primarily by the mitochondrial ATP synthase. ATP synthases operate by a rotary catalytic ...Adenosine triphosphate (ATP), the chemical energy currency of biology, is synthesized in eukaryotic cells primarily by the mitochondrial ATP synthase. ATP synthases operate by a rotary catalytic mechanism where proton translocation through the membrane-inserted FO region is coupled to ATP synthesis in the catalytic F1 region via rotation of a central rotor subcomplex. We report here single particle electron cryomicroscopy (cryo-EM) analysis of the bovine mitochondrial ATP synthase. Combining cryo-EM data with bioinformatic analysis allowed us to determine the fold of the a subunit, suggesting a proton translocation path through the FO region that involves both the a and b subunits. 3D classification of images revealed seven distinct states of the enzyme that show different modes of bending and twisting in the intact ATP synthase. Rotational fluctuations of the c8-ring within the FO region support a Brownian ratchet mechanism for proton-translocation-driven rotation in ATP synthases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3165.map.gz emd_3165.map.gz | 52 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3165-v30.xml emd-3165-v30.xml emd-3165.xml emd-3165.xml | 16.2 KB 16.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  EMD-3165.tif EMD-3165.tif EMDB-3165.tif EMDB-3165.tif | 127.4 KB 127.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3165 http://ftp.pdbj.org/pub/emdb/structures/EMD-3165 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3165 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3165 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3165_validation.pdf.gz emd_3165_validation.pdf.gz | 221.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3165_full_validation.pdf.gz emd_3165_full_validation.pdf.gz | 220.2 KB | 表示 | |
| XML形式データ |  emd_3165_validation.xml.gz emd_3165_validation.xml.gz | 6.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3165 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3165 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3165 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3165 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  5areMC  3164C  3166C  3167C  3168C  3169C  3170C  3181C  5araC  5arhC  5ariC  5fijC  5fikC  5filC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3165.map.gz / 形式: CCP4 / 大きさ: 62.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3165.map.gz / 形式: CCP4 / 大きさ: 62.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of detergent-solubilized bovine mitochondrial ATP synthase | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.64 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
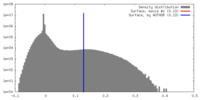
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Bovine mitochondrial ATP synthase
| 全体 | 名称: Bovine mitochondrial ATP synthase |
|---|---|
| 要素 |
|
-超分子 #1000: Bovine mitochondrial ATP synthase
| 超分子 | 名称: Bovine mitochondrial ATP synthase / タイプ: sample / ID: 1000 / 詳細: Detergent-solubilized protein complex / 集合状態: One hetero-oligomeric ATP synthase complex / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 600 KDa |
-分子 #1: ATP synthase
| 分子 | 名称: ATP synthase / タイプ: protein_or_peptide / ID: 1 / Name.synonym: ATPase, complex V / コピー数: 1 / 集合状態: monomer / 組換発現: No |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 実験値: 600 KDa |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 8 mg/mL |
|---|---|
| 緩衝液 | pH: 7.2 詳細: 20 mM Tris-HCl, 100 mM NaCl, 0.05% (wt/v) dodecylmaltoside, 2 mM ATP, 0.02% (wt/v) NaN3 |
| グリッド | 詳細: Homemade holey carbon on 400 square mesh Cu/Rh grid, glow-discharged 2 mins |
| 凍結 | 凍結剤: ETHANE-PROPANE MIXTURE / チャンバー内湿度: 100 % / 装置: FEI VITROBOT MARK III / 手法: Blot for 27 seconds before plunging |
- 電子顕微鏡法 #1
電子顕微鏡法 #1
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | FEI TITAN KRIOS |
| 温度 | 平均: 80 K |
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 18,000x magnification (before detector post-magnification) |
| 詳細 | K2 Summit direct detector device (Gatan Inc.) operated in super-resolution mode with a 1.64 angstrom physical pixel and 0.82 angstrom super-resolution pixel. With no specimen present, the rate of exposure of the detector was 8 electrons/pixel/second. Exposure- fractionated movies of 20.1 s were recorded as stacks of 67 frames, so that selected specimen areas were exposed with a total of 60.3 electrons/square angstrom. |
| 日付 | 2015年3月15日 |
| 撮影 | カテゴリ: CCD / フィルム・検出器のモデル: GATAN K2 (4k x 4k) / デジタル化 - サンプリング間隔: 5 µm / 実像数: 5867 / 平均電子線量: 60.3 e/Å2 / ビット/ピクセル: 8 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 30487 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.1 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 18000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 電子顕微鏡法 #2
電子顕微鏡法 #2
| Microscopy ID | 2 |
|---|---|
| 顕微鏡 | FEI TITAN KRIOS |
| 温度 | 平均: 80 K |
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 18,000x magnification (before detector post-magnification) |
| 詳細 | K2 Summit direct detector device (Gatan Inc.) operated in super-resolution mode with a 1.64 angstrom physical pixel and 0.82 angstrom super-resolution pixel. With no specimen present, the rate of exposure of the detector was 8 electrons/pixel/second. Exposure- fractionated movies of 20.1 s were recorded as stacks of 67 frames, so that selected specimen areas were exposed with a total of 60.3 electrons/square angstrom. |
| 日付 | 2014年9月28日 |
| 撮影 | カテゴリ: CCD / フィルム・検出器のモデル: GATAN K2 (4k x 4k) / デジタル化 - サンプリング間隔: 5 µm / 実像数: 5867 / 平均電子線量: 60.3 e/Å2 / ビット/ピクセル: 8 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 30487 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.1 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 18000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | The particles were selected using an automatic selection program. |
|---|---|
| CTF補正 | 詳細: Each particle |
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 7.4 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: Relion, FREALIGN 詳細: To avoid noise bias, only data up to a resolution of 10 angstrom were used during refinement. 使用した粒子像数: 22935 |
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - #0 - Chain ID: A / Chain - #1 - Chain ID: B / Chain - #2 - Chain ID: C / Chain - #3 - Chain ID: D / Chain - #4 - Chain ID: E / Chain - #5 - Chain ID: F / Chain - #6 - Chain ID: G / Chain - #7 - Chain ID: H / Chain - #8 - Chain ID: I / Chain - #9 - Chain ID: S |
|---|---|
| ソフトウェア | 名称: Chimera, MDFF |
| 詳細 | Rigid body fitting performed in Chimera first, followed by flexible fitting performed using Molecular Dynamics Flexible Fitting (MDFF). |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-5are: |
-原子モデル構築 2
| 初期モデル | PDB ID: Chain - #0 - Chain ID: J / Chain - #1 - Chain ID: K / Chain - #2 - Chain ID: L / Chain - #3 - Chain ID: M / Chain - #4 - Chain ID: N / Chain - #5 - Chain ID: O / Chain - #6 - Chain ID: P / Chain - #7 - Chain ID: Q |
|---|---|
| ソフトウェア | 名称: Chimera, MDFF |
| 詳細 | Rigid body fitting performed in Chimera first, followed by flexible fitting performed using Molecular Dynamics Flexible Fitting (MDFF). |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-5are: |
-原子モデル構築 3
| 初期モデル | PDB ID: Chain - #0 - Chain ID: D / Chain - #1 - Chain ID: E / Chain - #2 - Chain ID: F |
|---|---|
| ソフトウェア | 名称: Chimera, MDFF |
| 詳細 | Rigid body fitting performed in Chimera first, followed by flexible fitting performed using Molecular Dynamics Flexible Fitting (MDFF). |
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
| 得られたモデル |  PDB-5are: |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)