+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-30849 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of a human NHE1-CHP1 complex under pH 7.5, bound by cariporide | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Transporter / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of sodium:proton antiporter activity / sodium:proton antiporter activity involved in regulation of cardiac muscle cell membrane potential / cation-transporting ATPase complex / Sodium/Proton exchangers / negative regulation of phosphatase activity / regulation of the force of heart contraction by cardiac conduction / transporter complex / positive regulation of calcium:sodium antiporter activity / positive regulation of protein glycosylation / Hyaluronan uptake and degradation ...positive regulation of sodium:proton antiporter activity / sodium:proton antiporter activity involved in regulation of cardiac muscle cell membrane potential / cation-transporting ATPase complex / Sodium/Proton exchangers / negative regulation of phosphatase activity / regulation of the force of heart contraction by cardiac conduction / transporter complex / positive regulation of calcium:sodium antiporter activity / positive regulation of protein glycosylation / Hyaluronan uptake and degradation / membrane docking / regulation of cardiac muscle cell membrane potential / cellular response to electrical stimulus / potassium:proton antiporter activity / positive regulation of phospholipid biosynthetic process / negative regulation of protein autophosphorylation / sodium:proton antiporter activity / positive regulation of action potential / positive regulation of protein transport / maintenance of cell polarity / positive regulation of calcineurin-NFAT signaling cascade / regulation of pH / sodium ion export across plasma membrane / cardiac muscle cell differentiation / cellular response to acidic pH / membrane organization / sodium ion import across plasma membrane / ion binding / protein phosphatase 2B binding / intracellular sodium ion homeostasis / microtubule bundle formation / cardiac muscle cell contraction / response to acidic pH / regulation of stress fiber assembly / regulation of cardiac muscle contraction by calcium ion signaling / positive regulation of mitochondrial membrane permeability / cellular response to cold / negative regulation of calcineurin-NFAT signaling cascade / cellular response to antibiotic / regulation of focal adhesion assembly / negative regulation of protein import into nucleus / small GTPase-mediated signal transduction / negative regulation of NF-kappaB transcription factor activity / protein kinase inhibitor activity / positive regulation of cardiac muscle hypertrophy / positive regulation of the force of heart contraction / cellular response to organic cyclic compound / endoplasmic reticulum-Golgi intermediate compartment / intercalated disc / potassium channel regulator activity / positive regulation of protein targeting to membrane / monoatomic ion transport / cytoplasmic microtubule organization / potassium ion transmembrane transport / transport vesicle / negative regulation of protein ubiquitination / proton transmembrane transport / T-tubule / cellular response to epinephrine stimulus / response to muscle stretch / phosphatidylinositol-4,5-bisphosphate binding / protein export from nucleus / negative regulation of protein phosphorylation / stem cell differentiation / regulation of intracellular pH / negative regulation of protein kinase activity / potassium ion transport / phospholipid binding / kinase binding / cellular response to mechanical stimulus / cellular response to insulin stimulus / calcium-dependent protein binding / microtubule cytoskeleton / cell migration / lamellipodium / protein complex oligomerization / protein-macromolecule adaptor activity / cellular response to hypoxia / positive regulation of cell growth / microtubule binding / basolateral plasma membrane / molecular adaptor activity / membrane fusion / protein stabilization / calmodulin binding / positive regulation of apoptotic process / membrane raft / apical plasma membrane / Golgi membrane / focal adhesion / calcium ion binding / negative regulation of apoptotic process / perinuclear region of cytoplasm / cell surface / endoplasmic reticulum / positive regulation of transcription by RNA polymerase II / mitochondrion / extracellular exosome / nucleoplasm / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
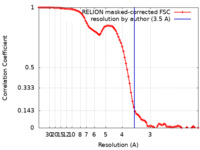
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Dong Y / Gao Y / Li B / Zhang XC / Zhao Y | |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Structure and mechanism of the human NHE1-CHP1 complex. 著者: Yanli Dong / Yiwei Gao / Alina Ilie / DuSik Kim / Annie Boucher / Bin Li / Xuejun C Zhang / John Orlowski / Yan Zhao /   要旨: Sodium/proton exchanger 1 (NHE1) is an electroneutral secondary active transporter present on the plasma membrane of most mammalian cells and plays critical roles in regulating intracellular pH and ...Sodium/proton exchanger 1 (NHE1) is an electroneutral secondary active transporter present on the plasma membrane of most mammalian cells and plays critical roles in regulating intracellular pH and volume homeostasis. Calcineurin B-homologous protein 1 (CHP1) is an obligate binding partner that promotes NHE1 biosynthetic maturation, cell surface expression and pH-sensitivity. Dysfunctions of either protein are associated with neurological disorders. Here, we elucidate structures of the human NHE1-CHP1 complex in both inward- and inhibitor (cariporide)-bound outward-facing conformations. We find that NHE1 assembles as a symmetrical homodimer, with each subunit undergoing an elevator-like conformational change during cation exchange. The cryo-EM map reveals the binding site for the NHE1 inhibitor cariporide, illustrating how inhibitors block transport activity. The CHP1 molecule differentially associates with these two conformational states of each NHE1 monomer, and this association difference probably underlies the regulation of NHE1 pH-sensitivity by CHP1. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_30849.map.gz emd_30849.map.gz | 32.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-30849-v30.xml emd-30849-v30.xml emd-30849.xml emd-30849.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_30849_fsc.xml emd_30849_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_30849.png emd_30849.png | 85.4 KB | ||
| Filedesc metadata |  emd-30849.cif.gz emd-30849.cif.gz | 6.2 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-30849 http://ftp.pdbj.org/pub/emdb/structures/EMD-30849 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30849 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-30849 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_30849_validation.pdf.gz emd_30849_validation.pdf.gz | 559.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_30849_full_validation.pdf.gz emd_30849_full_validation.pdf.gz | 558.8 KB | 表示 | |
| XML形式データ |  emd_30849_validation.xml.gz emd_30849_validation.xml.gz | 11 KB | 表示 | |
| CIF形式データ |  emd_30849_validation.cif.gz emd_30849_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30849 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30849 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30849 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-30849 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_30849.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_30849.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Human NHE1-CHP1 complex under pH 7.5, bound by cariporide
| 全体 | 名称: Human NHE1-CHP1 complex under pH 7.5, bound by cariporide |
|---|---|
| 要素 |
|
-超分子 #1: Human NHE1-CHP1 complex under pH 7.5, bound by cariporide
| 超分子 | 名称: Human NHE1-CHP1 complex under pH 7.5, bound by cariporide タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 230 KDa |
-超分子 #2: Sodium/protein exchanger 1 (NHE1) under pH 7.5, bound by cariporide
| 超分子 | 名称: Sodium/protein exchanger 1 (NHE1) under pH 7.5, bound by cariporide タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 182 KDa |
-超分子 #3: Calcineurin B homologous protein 1 (CHP1) under pH 7.5
| 超分子 | 名称: Calcineurin B homologous protein 1 (CHP1) under pH 7.5 タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 |
|---|
-分子 #1: Calcineurin B homologous protein 1
| 分子 | 名称: Calcineurin B homologous protein 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 21.36983 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: DEELEEIKKE TGFSHSQITR LYSRFTSLDK GENGTLSRED FQRIPELAIN PLGDRIINAF FPEGEDQVNF RGFMRTLAHF RPIEDNEKS KDVNGPEPLN SRSNKLHFAF RLYDLDKDEK ISRDELLQVL RMMVGVNISD EQLGSIADRT IQEADQDGDS A ASFTEFVK VLEKVDVEQK MSIRFLH UniProtKB: Calcineurin B homologous protein 1 |
-分子 #2: Sodium/hydrogen exchanger 1
| 分子 | 名称: Sodium/hydrogen exchanger 1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 57.100363 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: PRKAFPVLGI DYTHVRTPFE ISLWILLACL MKIGFHVIPT ISSIVPESCL LIVVGLLVGG LIKGVGETPP FLQSDVFFLF LLPPIILDA GYFLPLRQFT ENLGTILIFA VVGTLWNAFF LGGLMYAVCL VGGEQINNIG LLDNLLFGSI ISAVDPVAVL A VFEEIHIN ...文字列: PRKAFPVLGI DYTHVRTPFE ISLWILLACL MKIGFHVIPT ISSIVPESCL LIVVGLLVGG LIKGVGETPP FLQSDVFFLF LLPPIILDA GYFLPLRQFT ENLGTILIFA VVGTLWNAFF LGGLMYAVCL VGGEQINNIG LLDNLLFGSI ISAVDPVAVL A VFEEIHIN ELLHILVFGE SLLNDAVTVV LYHLFEEFAN YEHVGIVDIF LGFLSFFVVA LGGVLVGVVY GVIAAFTSRF TS HIRVIEP LFVFLYSYMA YLSAELFHLS GIMALIASGV VMRPYVEANI SHKSHTTIKY FLKMWSSVSE TLIFIFLGVS TVA GSHHWN WTFVISTLLF CLIARVLGVL GLTWFINKFR IVKLTPKDQF IIAYGGLRGA IAFSLGYLLD KKHFPMCDLF LTAI ITVIF FTVFVQGMTI RPLVDLLAVK KKQETKRSIN EEIHTQFLDH LLTGIEDICG HYGHHHWKDK LNRFNKKYVK KCLIA GERS KEPQLIAFYH KMEMKQAIEL VESGG UniProtKB: Sodium/hydrogen exchanger 1 |
-分子 #3: (1S)-2-{[{[(2R)-2,3-DIHYDROXYPROPYL]OXY}(HYDROXY)PHOSPHORYL]OXY}-...
| 分子 | 名称: (1S)-2-{[{[(2R)-2,3-DIHYDROXYPROPYL]OXY}(HYDROXY)PHOSPHORYL]OXY}-1-[(PALMITOYLOXY)METHYL]ETHYL STEARATE タイプ: ligand / ID: 3 / コピー数: 6 / 式: PGT |
|---|---|
| 分子量 | 理論値: 751.023 Da |
| Chemical component information |  ChemComp-PGT: |
-分子 #4: N-[bis(azanyl)methylidene]-3-methylsulfonyl-4-propan-2-yl-benzamide
| 分子 | 名称: N-[bis(azanyl)methylidene]-3-methylsulfonyl-4-propan-2-yl-benzamide タイプ: ligand / ID: 4 / コピー数: 2 / 式: HG0 |
|---|---|
| 分子量 | 理論値: 283.347 Da |
| Chemical component information |  ChemComp-HG0: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 6 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK III |
| 詳細 | The NHE1-CHP1 complex was reconstituted into lipid nanodiscs. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / デジタル化 - 画像ごとのフレーム数: 1-32 / 撮影したグリッド数: 1 / 実像数: 3855 / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.2 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 13000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-7dsx: |
 ムービー
ムービー コントローラー
コントローラー