登録情報 データベース : EMDB / ID : EMD-29068タイトル Cryo-EM structure of the GR-Hsp90-FKBP52 complex Sharpened consensus GR-Hsp90-FKBP52 map 複合体 : Complex of the Glucocorticoid Receptor ligand binding domain, Hsp90 alpha dimer, and the co-chaperone FKBP52タンパク質・ペプチド : Heat shock protein HSP 90-alphaタンパク質・ペプチド : Glucocorticoid receptorタンパク質・ペプチド : Peptidyl-prolyl cis-trans isomerase FKBP4, N-terminally processedリガンド : ADENOSINE-5'-TRIPHOSPHATEリガンド : MAGNESIUM IONリガンド : DEXAMETHASONE / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
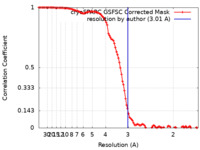
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 3.01 Å Noddings CM / Agard DA 資金援助 Organization Grant number 国 National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) GM118099
ジャーナル : Nat Struct Mol Biol / 年 : 2023タイトル : Cryo-EM reveals how Hsp90 and FKBP immunophilins co-regulate the glucocorticoid receptor.著者 : Chari M Noddings / Jill L Johnson / David A Agard / 要旨 : Hsp90 is an essential molecular chaperone responsible for the folding and activation of hundreds of 'client' proteins, including the glucocorticoid receptor (GR). Previously, we revealed that Hsp70 ... Hsp90 is an essential molecular chaperone responsible for the folding and activation of hundreds of 'client' proteins, including the glucocorticoid receptor (GR). Previously, we revealed that Hsp70 and Hsp90 remodel the conformation of GR to regulate ligand binding, aided by co-chaperones. In vivo, the co-chaperones FKBP51 and FKBP52 antagonistically regulate GR activity, but a molecular understanding is lacking. Here we present a 3.01 Å cryogenic electron microscopy structure of the human GR:Hsp90:FKBP52 complex, revealing how FKBP52 integrates into the GR chaperone cycle and directly binds to the active client, potentiating GR activity in vitro and in vivo. We also present a 3.23 Å cryogenic electron microscopy structure of the human GR:Hsp90:FKBP51 complex, revealing how FKBP51 competes with FKBP52 for GR:Hsp90 binding and demonstrating how FKBP51 can act as a potent antagonist to FKBP52. Altogether, we demonstrate how FKBP51 and FKBP52 integrate into the GR chaperone cycle to advance GR to the next stage of maturation. 履歴 登録 2022年12月10日 - ヘッダ(付随情報) 公開 2023年11月1日 - マップ公開 2023年11月1日 - 更新 2023年12月20日 - 現状 2023年12月20日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 米国, 1件
米国, 1件  引用
引用 ジャーナル: Nat Struct Mol Biol / 年: 2023
ジャーナル: Nat Struct Mol Biol / 年: 2023
 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_29068.map.gz
emd_29068.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-29068-v30.xml
emd-29068-v30.xml emd-29068.xml
emd-29068.xml EMDBヘッダ
EMDBヘッダ emd_29068_fsc.xml
emd_29068_fsc.xml FSCデータファイル
FSCデータファイル emd_29068.png
emd_29068.png emd_29068_msk_1.map
emd_29068_msk_1.map emd_29068_msk_2.map
emd_29068_msk_2.map emd_29068_msk_3.map
emd_29068_msk_3.map マスクマップ
マスクマップ emd-29068.cif.gz
emd-29068.cif.gz emd_29068_additional_1.map.gz
emd_29068_additional_1.map.gz emd_29068_additional_2.map.gz
emd_29068_additional_2.map.gz emd_29068_additional_3.map.gz
emd_29068_additional_3.map.gz emd_29068_additional_4.map.gz
emd_29068_additional_4.map.gz emd_29068_half_map_1.map.gz
emd_29068_half_map_1.map.gz emd_29068_half_map_2.map.gz
emd_29068_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-29068
http://ftp.pdbj.org/pub/emdb/structures/EMD-29068 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29068
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29068

 F&H 検索
F&H 検索 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_29068.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_29068.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) emd_29068_msk_1.map
emd_29068_msk_1.map emd_29068_msk_2.map
emd_29068_msk_2.map emd_29068_msk_3.map
emd_29068_msk_3.map 試料の構成要素
試料の構成要素 Homo sapiens (ヒト)
Homo sapiens (ヒト) Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)
 Homo sapiens (ヒト)
Homo sapiens (ヒト)


 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析
 ムービー
ムービー コントローラー
コントローラー




































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)