+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM Structure of Extended eEF1A bound to the Ribosome in the Classical Pre State | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoplasmic side of lysosomal membrane / Eukaryotic Translation Elongation / eukaryotic translation elongation factor 1 complex / regulation of chaperone-mediated autophagy / translation factor activity, RNA binding / translational elongation / positive regulation of lipid kinase activity / translation elongation factor activity / translation / positive regulation of apoptotic process ...cytoplasmic side of lysosomal membrane / Eukaryotic Translation Elongation / eukaryotic translation elongation factor 1 complex / regulation of chaperone-mediated autophagy / translation factor activity, RNA binding / translational elongation / positive regulation of lipid kinase activity / translation elongation factor activity / translation / positive regulation of apoptotic process / GTPase activity / synapse / GTP binding / protein kinase binding / cytoplasm 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  human (ヒト) human (ヒト) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.9 Å | ||||||||||||
 データ登録者 データ登録者 | Gemmer M / Fedry JMM / Forster FG | ||||||||||||
| 資金援助 | European Union,  オランダ, 3件 オランダ, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: Visualization of translation and protein biogenesis at the ER membrane. 著者: Max Gemmer / Marten L Chaillet / Joyce van Loenhout / Rodrigo Cuevas Arenas / Dimitrios Vismpas / Mariska Gröllers-Mulderij / Fujiet A Koh / Pascal Albanese / Richard A Scheltema / Stuart C ...著者: Max Gemmer / Marten L Chaillet / Joyce van Loenhout / Rodrigo Cuevas Arenas / Dimitrios Vismpas / Mariska Gröllers-Mulderij / Fujiet A Koh / Pascal Albanese / Richard A Scheltema / Stuart C Howes / Abhay Kotecha / Juliette Fedry / Friedrich Förster /  要旨: The dynamic ribosome-translocon complex, which resides at the endoplasmic reticulum (ER) membrane, produces a major fraction of the human proteome. It governs the synthesis, translocation, membrane ...The dynamic ribosome-translocon complex, which resides at the endoplasmic reticulum (ER) membrane, produces a major fraction of the human proteome. It governs the synthesis, translocation, membrane insertion, N-glycosylation, folding and disulfide-bond formation of nascent proteins. Although individual components of this machinery have been studied at high resolution in isolation, insights into their interplay in the native membrane remain limited. Here we use cryo-electron tomography, extensive classification and molecular modelling to capture snapshots of mRNA translation and protein maturation at the ER membrane at molecular resolution. We identify a highly abundant classical pre-translocation intermediate with eukaryotic elongation factor 1a (eEF1a) in an extended conformation, suggesting that eEF1a may remain associated with the ribosome after GTP hydrolysis during proofreading. At the ER membrane, distinct polysomes bind to different ER translocons specialized in the synthesis of proteins with signal peptides or multipass transmembrane proteins with the translocon-associated protein complex (TRAP) present in both. The near-complete atomic model of the most abundant ER translocon variant comprising the protein-conducting channel SEC61, TRAP and the oligosaccharyltransferase complex A (OSTA) reveals specific interactions of TRAP with other translocon components. We observe stoichiometric and sub-stoichiometric cofactors associated with OSTA, which are likely to include protein isomerases. In sum, we visualize ER-bound polysomes with their coordinated downstream machinery. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
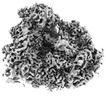
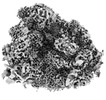
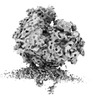
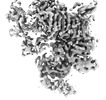
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15893.map.gz emd_15893.map.gz | 268.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15893-v30.xml emd-15893-v30.xml emd-15893.xml emd-15893.xml | 21 KB 21 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_15893.png emd_15893.png | 135.7 KB | ||
| その他 |  emd_15893_half_map_1.map.gz emd_15893_half_map_1.map.gz emd_15893_half_map_2.map.gz emd_15893_half_map_2.map.gz | 383.6 MB 383.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15893 http://ftp.pdbj.org/pub/emdb/structures/EMD-15893 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15893 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15893 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15893_validation.pdf.gz emd_15893_validation.pdf.gz | 827.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15893_full_validation.pdf.gz emd_15893_full_validation.pdf.gz | 827.1 KB | 表示 | |
| XML形式データ |  emd_15893_validation.xml.gz emd_15893_validation.xml.gz | 17.5 KB | 表示 | |
| CIF形式データ |  emd_15893_validation.cif.gz emd_15893_validation.cif.gz | 20.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15893 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15893 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15893 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15893 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8b6zMC  8b6lC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15893.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15893.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.999 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_15893_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
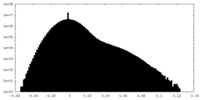
| 投影像・断面図 |
| ||||||||||||
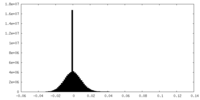
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_15893_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
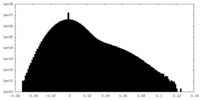
| 投影像・断面図 |
| ||||||||||||
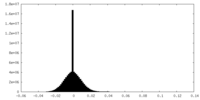
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Ribosome in the Classical Pre+ state
| 全体 | 名称: Ribosome in the Classical Pre+ state |
|---|---|
| 要素 |
|
-超分子 #1: Ribosome in the Classical Pre+ state
| 超分子 | 名称: Ribosome in the Classical Pre+ state / タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Elongation factor 1-alpha 2
| 分子 | 名称: Elongation factor 1-alpha 2 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  human (ヒト) human (ヒト) |
| 分子量 | 理論値: 50.545102 KDa |
| 配列 | 文字列: MGKEKTHINI VVIGHVDSGK STTTGHLIYK CGGIDKRTIE KFEKEAAEMG KGSFKYAWVL DKLKAERERG ITIDISLWKF ETTKYYITI IDAPGHRDFI KNMITGTSQA DCAVLIVAAG VGEFEAGISK NGQTREHALL AYTLGVKQLI VGVNKMDSTE P AYSEKRYD ...文字列: MGKEKTHINI VVIGHVDSGK STTTGHLIYK CGGIDKRTIE KFEKEAAEMG KGSFKYAWVL DKLKAERERG ITIDISLWKF ETTKYYITI IDAPGHRDFI KNMITGTSQA DCAVLIVAAG VGEFEAGISK NGQTREHALL AYTLGVKQLI VGVNKMDSTE P AYSEKRYD EIVKEVSAYI KKIGYNPATV PFVPISGWHG DNMLEPSPNM PWFKGWKVER KEGNASGVSL LEALDTILPP TR PTDKPLR LPLQDVYKIG GIGTVPVGRV ETGILRPGMV VTFAPVNITT EVKSVEMHHE ALSEALPGDN VGFNVKNVSV KDI RRGNVC GDSKSDPPQE AAQFTSQVII LNHPGQISAG YSPVIDCHTA HIACKFAELK EKIDRRSGKK LEDNPKSLKS GDAA IVEMV PGKPMCVESF SQYPPLGRFA VRDMRQTVAV GVIKNVEKKS GGAGKVTKSA QKAQKAGK |
-分子 #2: 28S ribosomal RNA
| 分子 | 名称: 28S ribosomal RNA / タイプ: rna / ID: 2 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種:  human (ヒト) human (ヒト) |
| 分子量 | 理論値: 1.640222125 MDa |
| 配列 | 文字列: CGCGACCUCA GAUCAGACGU GGCGACCCGC UGAAUUUAAG CAUAUUAGUC AGCGGAGGAG AAGAAACUAA CCAGGAUUCC CUCAGUAAC GGCGAGUGAA CAGGGAAGAG CCCAGCGCCG AAUCCCCGCC CCGCGGCGGG GCGCGGGACA UGUGGCGUAC G GAAGACCC ...文字列: CGCGACCUCA GAUCAGACGU GGCGACCCGC UGAAUUUAAG CAUAUUAGUC AGCGGAGGAG AAGAAACUAA CCAGGAUUCC CUCAGUAAC GGCGAGUGAA CAGGGAAGAG CCCAGCGCCG AAUCCCCGCC CCGCGGCGGG GCGCGGGACA UGUGGCGUAC G GAAGACCC GCUCCCCGGC GCCGCUCGUG GGGGGCCCAA GUCCUUCUGA UCGAGGCCCA GCCCGUGGAC GGUGUGAGGC CG GUAGCGG CCCCCGGCGC GCCGGGCCCG GGUCUUCCCG GAGUCGGGUU GCUUGGGAAU GCAGCCCAAA GCGGGUGGUA AAC UCCAUC UAAGGCUAAA UACCGGCACG AGACCGAUAG UCAACAAGUA CCGUAAGGGA AAGUUGAAAA GAACUUUGAA GAGA GAGUU CAAGAGGGCG UGAAACCGUU AAGAGGUAAA CGGGUGGGGU CCGCGCAGUC CGCCCGGAGG AUUCAACCCG GCGGC GGGU CCGGCCGUGU CGGCGGCCCG GCGGAUCUUU CCCGCCCCCC GUUCCUCCCG ACCCCUCCAC CCGCCCUCCC UUCCCC CGC CGCCCCUCCU CCUCCUCCCC GGAGGGGGCG GGCUCCGGCG GGUGCGGGGG UGGGCGGGCG GGGCCGGGGG UGGGGUC GG CGGGGGACCG UCCCCCGACC GGCGACCGGC CGCCGCCGGG CGCAUUUCCA CCGCGGCGGU GCGCCGCGAC CGGCUCCG G GACGGCUGGG AAGGCCCGGC GGGGAAGGUG GCUCGGGGGG CCCCGUCCGU CCGUCCGUCC GUCCUCCUCC UCCCCCGUC UCCGCCCCCC GGCCCCGCGU CCUCCCUCGG GAGGGCGCGC GGGUCGGGGC GGCGGCGGCG GCGGCGGUGG CGGCGGCGGC GGCGGCGGC GGGACCGAAA CCCCCCCCGA GUGUUACAGC CCCCCCGGCA GCAGCACUCG CCGAAUCCCG GGGCCGAGGG A GCGAGACC CGUCGCCGCG CUCUCCCCCC UCCCGGCGCC CACCCCCGCG GGGAAUCCCC CGCGAGGGGG GUCUCCCCCG CG GGGGCGC GCCGGCGUCU CCUCGUGGGG GGGCCGGGCC ACCCCUCCCA CGGCGCGACC GCUCUCCCAC CCCUCCUCCC CGC GCCCCC GCCCCGGCGA CGGGGGGGGU GCCGCGCGCG GGUCGGGGGG CGGGGCGGAC UGUCCCCAGU GCGCCCCGGG CGGG UCGCG CCGUCGGGCC CGGGGGAGGU UCUCUCGGGG CCACGCGCGC GUCCCCCGAA GAGGGGGACG GCGGAGCGAG CGCAC GGGG UCGGCGGCGA CGUCGGCUAC CCACCCGACC CGUCUUGAAA CACGGACCAA GGAGUCUAAC ACGUGCGCGA GUCGGG GGC UCGCACGAAA GCCGCCGUGG CGCAAUGAAG GUGAAGGCCG GCGCGCUCGC CGGCCGAGGU GGGAUCCCGA GGCCUCU CC AGUCCGCCGA GGGCGCACCA CCGGCCCGUC UCGCCCGCCG CGCCGGGGAG GUGGAGCACG AGCGCACGUG UUAGGACC C GAAAGAUGGU GAACUAUGCC UGGGCAGGGC GAAGCCAGAG GAAACUCUGG UGGAGGUCCG UAGCGGUCCU GACGUGCAA AUCGGUCGUC CGACCUGGGU AUAGGGGCGA AAGACUAAUC GAACCAUCUA GUAGCUGGUU CCCUCCGAAG UUUCCCUCAG GAUAGCUGG CGCUCUCGCA GACCCGACGC ACCCCCGCCA CGCAGUUUUA UCCGGUAAAG CGAAUGAUUA GAGGUCUUGG G GCCGAAAC GAUCUCAACC UAUUCUCAAA CUUUAAAUGG GUAAGAAGCC CGGCUCGCUG GCGUGGAGCC GGGCGUGGAA UG CGAGUGC CUAGUGGGCC ACUUUUGGUA AGCAGAACUG GCGCUGCGGG AUGAACCGAA CGCCGGGUUA AGGCGCCCGA UGC CGACGC UCAUCAGACC CCAGAAAAGG UGUUGGUUGA UAUAGACAGC AGGACGGUGG CCAUGGAAGU CGGAAUCCGC UAAG GAGUG UGUAACAACU CACCUGCCGA AUCAACUAGC CCUGAAAAUG GAUGGCGCUG GAGCGUCGGG CCCAUACCCG GCCGU CGCC GGCAGUCGAG AGUGGACGGG AGCGGCGGGG GCGGCGCGCG CGCGCGCGCG UGUGGUGUGC GUCGGAGGGC GGCGGC GGC GGCGGCGGCG GGGGUGUGGG GUCCUUCCCC CGCCCCCCCC CCCACGCCUC CUCCCCUCCU CCCGCCCACG CCCCGCU CC CCGCCCCCGG AGCCCCGCGG ACGCUACGCC GCGACGAGUA GGAGGGCCGC UGCGGUGAGC CUUGAAGCCU AGGGCGCG G GCCCGGGUGG AGCCGCCGCA GGUGCAGAUC UUGGUGGUAG UAGCAAAUAU UCAAACGAGA ACUUUGAAGG CCGAAGUGG AGAAGGGUUC CAUGUGAACA GCAGUUGAAC AUGGGUCAGU CGGUCCUGAG AGAUGGGCGA GCGCCGUUCC GAAGGGACGG GCGAUGGCC UCCGUUGCCC UCGGCCGAUC GAAAGGGAGU CGGGUUCAGA UCCCCGAAUC CGGAGUGGCG GAGAUGGGCG C CGCGAGGC GUCCAGUGCG GUAACGCGAC CGAUCCCGGA GAAGCCGGCG GGAGCCCCGG GGAGAGUUCU CUUUUCUUUG UG AAGGGCA GGGCGCCCUG GAAUGGGUUC GCCCCGAGAG AGGGGCCCGU GCCUUGGAAA GCGUCGCGGU UCCGGCGGCG UCC GGUGAG CUCUCGCUGG CCCUUGAAAA UCCGGGGGAG AGGGUGUAAA UCUCGCGCCG GGCCGUACCC AUAUCCGCAG CAGG UCUCC AAGGUGAACA GCCUCUGGCA UGUUGGAACA AUGUAGGUAA GGGAAGUCGG CAAGCCGGAU CCGUAACUUC GGGAU AAGG AUUGGCUCUA AGGGCUGGGU CGGUCGGGCU GGGGCGCGAA GCGGGGCUGG GCGCGCGCCG CGGCUGGACG AGGCGC CGC CGCCCCCCCC ACGCCCGGGG CACCCCCCUC GCGGCCCUCC CCCGCCCCAC CCCGCGCGCG CCGCUCGCUC CCUCCCC GC CCCGCGCCCU CUCUCUCUCU CUCUCCCCCG CUCCCCGUCC UCCCCCCUCC CCGGGGGAGC GCCGCGUGGG GGCGGCGG C GGGGGGAGAA GGGUCGGGGC GGCAGGGGCC GGCGGCGGCC CGCCGCGGGG CCCCGGCGGC GGGGGCACGG UCCCCCGCG AGGGGGGCCC GGGCACCCGG GGGGCCGGCG GCGGCGGCGA CUCUGGACGC GAGCCGGGCC CUUCCCGUGG AUCGCCCCAG CUGCGGCGG GCGUCGCGGC CGCCCCCGGG GAGCCCGGCG GGCGCCGGCG CGCCCCCCCC CCCACCCCAC GUCUCGUCGC G CGCGCGUC CGCUGGGGGC GGGGAGCGGU CGGGCGGCGG CGGUCGGCGG GCGGCGGGGC GGGGCGGUUC GUCCCCCCGC CC UACCCCC CCGGCCCCGU CCGCCCCCCG UUCCCCCCUC CUCCUCGGCG CGCGGCGGCG GCGGCGGCAG GCGGCGGAGG GGC CGCGGG CCGGUCCCCC CCGCCGGGUC CGCCCCCGGG GCCGCGGUUC CGCGCGGCGC CUCGCCUCGG CCGGCGCCUA GCAG CCGAC UUAGAACUGG UGCGGACCAG GGGAAUCCGA CUGUUUAAUU AAAACAAAGC AUCGCGAAGG CCCGCGGCGG GUGUU GACG CGAUGUGAUU UCUGCCCAGU GCUCUGAAUG UCAAAGUGAA GAAAUUCAAU GAAGCGCGGG UAAACGGCGG GAGUAA CUA UGACUCUCUU AAGGUAGCCA AAUGCCUCGU CAUCUAAUUA GUGACGCGCA UGAAUGGAUG AACGAGAUUC CCACUGU CC CUACCUACUA UCCAGCGAAA CCACAGCCAA GGGAACGGGC UUGGCGGAAU CAGCGGGGAA AGAAGACCCU GUUGAGCU U GACUCUAGUC UGGCACGGUG AAGAGACAUG AGAGGUGUAG AAUAAGUGGG AGGCCCCCGG CGCCCCCCCG GUGUCCCCG CGAGGGGCCC GGGGCGGGGU CCGCCGGCCC UGCGGGCCGC CGGUGAAAUA CCACUACUCU GAUCGUUUUU UCACUGACCC GGUGAGGCG GGGGGGCGAG CCCCGAGGGG CUCUCGCUUC UGGCGCCAAG CGCCCGGCCG CGCGCCGGCC GGGCGCGACC C GCUCCGGG GACAGUGCCA GGUGGGGAGU UUGACUGGGG CGGUACACCU GUCAAACGGU AACGCAGGUG UCCUAAGGCG AG CUCAGGG AGGACAGAAA CCUCCCGUGG AGCAGAAGGG CAAAAGCUCG CUUGAUCUUG AUUUUCAGUA CGAAUACAGA CCG UGAAAG CGGGGCCUCA CGAUCCUUCU GACCUUUUGG GUUUUAAGCA GGAGGUGUCA GAAAAGUUAC CACAGGGAUA ACUG GCUUG UGGCGGCCAA GCGUUCAUAG CGACGUCGCU UUUUGAUCCU UCGAUGUCGG CUCUUCCUAU CAUUGUGAAG CAGAA UUCA CCAAGCGUUG GAUUGUUCAC CCACUAAUAG GGAACGUGAG CUGGGUUUAG ACCGUCGUGA GACAGGUUAG UUUUAC CCU ACUGAUGAUG UGUUGUUGCC AUGGUAAUCC UGCUCAGUAC GAGAGGAACC GCAGGUUCAG ACAUUUGGUG UAUGUGC UU GGCUGAGGAG CCAAUGGGGC GAAGCUACCA UCUGUGGGAU UAUGACUGAA CGCCUCUAAG UCAGAAUCCC GCCCAGGC G GAACGAUACG GCAGCGCCGC GGAGCCUCGG UUGGCCUCGG AUAGCCGGUC CCCCGCCUGU CCCCGCCGGC GGGCCGCCC CCCCCCUCCA CGCGCCCCGC GCGCGCGGGA GGGCGCGUGC CCCGCCGCGC GCCGGGACCG GGGUCCGGUG CGGAGUGCCC UUCGUCCUG GGAAACGGGG CGCGGCCGGA GAGGCGGCCG CCCCCUCGCC CGUCACGCAC CGCACGUUCG UGGGGAACCU G GCGCUAAA CCAUUCGUAG ACGACCUGCU UCUGGGUCGG GGUUUCGUAC GUAGCAGAGC AGCUCCCUCG CUGCGAUCUA UU GAAAGUC AGCCCUCGAC ACAAGGGUUU GUC |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: Quantifoil R3.5/1 / 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 0.2 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - 点群: C1 (非対称) / 解像度のタイプ: BY AUTHOR / 解像度: 2.9 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: RELION / 使用した粒子像数: 19046 |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: RELION |
| 最終 3次元分類 | ソフトウェア - 名称: RELION |
 ムービー
ムービー コントローラー
コントローラー

























 Z
Z Y
Y X
X