+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Paired helical tau filaments from high-spin supernatants of aqueous extracts from Alzheimer's disease brains | PHF Tau | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | amyloid / filaments / tau / PHF / cryo-EM / PROTEIN FIBRIL | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報plus-end-directed organelle transport along microtubule / histone-dependent DNA binding / negative regulation of establishment of protein localization to mitochondrion / neurofibrillary tangle / microtubule lateral binding / main axon / axonal transport / tubulin complex / positive regulation of protein localization to synapse / phosphatidylinositol bisphosphate binding ...plus-end-directed organelle transport along microtubule / histone-dependent DNA binding / negative regulation of establishment of protein localization to mitochondrion / neurofibrillary tangle / microtubule lateral binding / main axon / axonal transport / tubulin complex / positive regulation of protein localization to synapse / phosphatidylinositol bisphosphate binding / negative regulation of tubulin deacetylation / generation of neurons / rRNA metabolic process / axonal transport of mitochondrion / regulation of chromosome organization / regulation of mitochondrial fission / axon development / regulation of long-term synaptic depression / central nervous system neuron development / intracellular distribution of mitochondria / regulation of microtubule polymerization / microtubule polymerization / lipoprotein particle binding / minor groove of adenine-thymine-rich DNA binding / negative regulation of mitochondrial membrane potential / dynactin binding / apolipoprotein binding / axolemma / protein polymerization / glial cell projection / negative regulation of mitochondrial fission / Caspase-mediated cleavage of cytoskeletal proteins / regulation of microtubule polymerization or depolymerization / neurofibrillary tangle assembly / positive regulation of axon extension / Activation of AMPK downstream of NMDARs / regulation of cellular response to heat / supramolecular fiber organization / synapse assembly / positive regulation of protein localization / cellular response to brain-derived neurotrophic factor stimulus / somatodendritic compartment / regulation of calcium-mediated signaling / cytoplasmic microtubule organization / positive regulation of microtubule polymerization / axon cytoplasm / stress granule assembly / phosphatidylinositol binding / regulation of microtubule cytoskeleton organization / nuclear periphery / protein phosphatase 2A binding / positive regulation of superoxide anion generation / cellular response to reactive oxygen species / astrocyte activation / Hsp90 protein binding / microglial cell activation / response to lead ion / cellular response to nerve growth factor stimulus / synapse organization / PKR-mediated signaling / protein homooligomerization / regulation of synaptic plasticity / SH3 domain binding / microtubule cytoskeleton organization / cytoplasmic ribonucleoprotein granule / memory / neuron projection development / cell-cell signaling / single-stranded DNA binding / protein-folding chaperone binding / actin binding / cellular response to heat / microtubule cytoskeleton / cell body / growth cone / double-stranded DNA binding / protein-macromolecule adaptor activity / microtubule binding / dendritic spine / sequence-specific DNA binding / amyloid fibril formation / microtubule / learning or memory / neuron projection / regulation of autophagy / membrane raft / axon / negative regulation of gene expression / neuronal cell body / dendrite / DNA damage response / protein kinase binding / enzyme binding / mitochondrion / DNA binding / RNA binding / extracellular region / identical protein binding / nucleus / plasma membrane 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
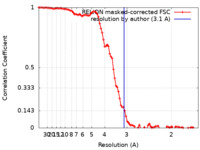
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | ||||||||||||
 データ登録者 データ登録者 | Yang Y / Stern MA / Meunier LA / Liu W / Cai YQ / Ericsson M / Liu L / Selkoe JD / Goedert M / Scheres HWS | ||||||||||||
| 資金援助 |  英国, 3件 英国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Neuron / 年: 2023 ジャーナル: Neuron / 年: 2023タイトル: Abundant Aβ fibrils in ultracentrifugal supernatants of aqueous extracts from Alzheimer's disease brains. 著者: Andrew M Stern / Yang Yang / Shanxue Jin / Keitaro Yamashita / Angela L Meunier / Wen Liu / Yuqi Cai / Maria Ericsson / Lei Liu / Michel Goedert / Sjors H W Scheres / Dennis J Selkoe /   要旨: Soluble oligomers of amyloid β-protein (Aβ) have been defined as aggregates in supernatants following ultracentrifugation of aqueous extracts from Alzheimer's disease (AD) brains and are believed ...Soluble oligomers of amyloid β-protein (Aβ) have been defined as aggregates in supernatants following ultracentrifugation of aqueous extracts from Alzheimer's disease (AD) brains and are believed to be upstream initiators of synaptic dysfunction, but little is known about their structures. We now report the unexpected presence of Aβ fibrils in synaptotoxic high-speed supernatants from AD brains extracted by soaking in an aqueous buffer. The fibrils did not appear to form during preparation, and their counts by EM correlated with Aβ ELISA quantification. Cryo-EM structures of aqueous Aβ fibrils were identical to those from sarkosyl-insoluble homogenates. The fibrils in aqueous extracts were labeled by lecanemab, an Aβ aggregate-directed antibody reported to improve AD cognitive outcomes. Lecanemab provided protection against aqueous fibril synaptotoxicity. We conclude that fibrils are abundant in aqueous extracts from AD brains and have the same structures as those from plaques. These findings have implications for AD pathogenesis and drug design. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15772.map.gz emd_15772.map.gz | 25.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15772-v30.xml emd-15772-v30.xml emd-15772.xml emd-15772.xml | 15.3 KB 15.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15772_fsc.xml emd_15772_fsc.xml | 9.2 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15772.png emd_15772.png | 82.9 KB | ||
| マスクデータ |  emd_15772_msk_1.map emd_15772_msk_1.map | 64 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-15772.cif.gz emd-15772.cif.gz | 5.4 KB | ||
| その他 |  emd_15772_half_map_1.map.gz emd_15772_half_map_1.map.gz emd_15772_half_map_2.map.gz emd_15772_half_map_2.map.gz | 25.2 MB 25.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15772 http://ftp.pdbj.org/pub/emdb/structures/EMD-15772 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15772 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15772 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15772_validation.pdf.gz emd_15772_validation.pdf.gz | 915.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15772_full_validation.pdf.gz emd_15772_full_validation.pdf.gz | 915.4 KB | 表示 | |
| XML形式データ |  emd_15772_validation.xml.gz emd_15772_validation.xml.gz | 16.2 KB | 表示 | |
| CIF形式データ |  emd_15772_validation.cif.gz emd_15772_validation.cif.gz | 21.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15772 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15772 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15772 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15772 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15772.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15772.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.831 Å | ||||||||||||||||||||||||||||||||||||
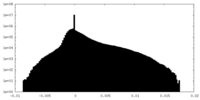
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15772_msk_1.map emd_15772_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
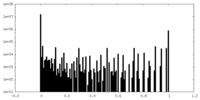
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_15772_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
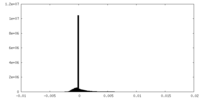
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_15772_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
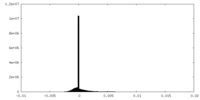
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Paired helical tau filament in soluble high-molecular weight aggr...
| 全体 | 名称: Paired helical tau filament in soluble high-molecular weight aggregate fractions extracted from the Alzheimer's disease brain |
|---|---|
| 要素 |
|
-超分子 #1: Paired helical tau filament in soluble high-molecular weight aggr...
| 超分子 | 名称: Paired helical tau filament in soluble high-molecular weight aggregate fractions extracted from the Alzheimer's disease brain タイプ: tissue / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Microtubule-associated protein tau
| 分子 | 名称: Microtubule-associated protein tau / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 45.919871 KDa |
| 配列 | 文字列: MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEDVTAPLV DEGAPGKQA AAQPHTEIPE GTTAEEAGIG DTPSLEDEAA GHVTQARMVS KSKDGTGSDD KKAKGADGKT KIATPRGAAP P GQKGQANA ...文字列: MAEPRQEFEV MEDHAGTYGL GDRKDQGGYT MHQDQEGDTD AGLKESPLQT PTEDGSEEPG SETSDAKSTP TAEDVTAPLV DEGAPGKQA AAQPHTEIPE GTTAEEAGIG DTPSLEDEAA GHVTQARMVS KSKDGTGSDD KKAKGADGKT KIATPRGAAP P GQKGQANA TRIPAKTPPA PKTPPSSGEP PKSGDRSGYS SPGSPGTPGS RSRTPSLPTP PTREPKKVAV VRTPPKSPSS AK SRLQTAP VPMPDLKNVK SKIGSTENLK HQPGGGKVQI INKKLDLSNV QSKCGSKDNI KHVPGGGSVQ IVYKPVDLSK VTS KCGSLG NIHHKPGGGQ VEVKSEKLDF KDRVQSKIGS LDNITHVPGG GNKKIETHKL TFRENAKAKT DHGAEIVYKS PVVS GDTSP RHLSNVSSTG SIDMVDSPQL ATLADEVSAS LAKQGL UniProtKB: Microtubule-associated protein tau |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)