+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-13843 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of VgrG1 from Pseudomonas protegens. | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | bacterial type VI secretion system / TOXIN / VgrG | |||||||||
| 機能・相同性 | Bacteriophage T4 gp5 C-terminal trimerisation domain / Type VI secretion system, RhsGE-associated Vgr family subset / Type VI secretion system, RhsGE-associated Vgr protein / Phage tail baseplate hub (GPD) / Gp5/Type VI secretion system Vgr protein, OB-fold domain / Type VI secretion system/phage-baseplate injector OB domain / Vgr protein, OB-fold domain superfamily / : / Type VI secretion protein VgrG 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Pseudomonas protegens Pf-5 (バクテリア) / Pseudomonas protegens Pf-5 (バクテリア) /  Pseudomonas fluorescens (strain ATCC BAA-477 / NRRL B-23932 / Pf-5) (バクテリア) Pseudomonas fluorescens (strain ATCC BAA-477 / NRRL B-23932 / Pf-5) (バクテリア) | |||||||||
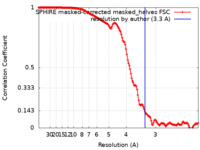
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||
 データ登録者 データ登録者 | Guenther P / Quentin D | |||||||||
| 資金援助 | 2件
| |||||||||
 引用 引用 |  ジャーナル: PLoS Pathog / 年: 2022 ジャーナル: PLoS Pathog / 年: 2022タイトル: Structure of a bacterial Rhs effector exported by the type VI secretion system. 著者: Patrick Günther / Dennis Quentin / Shehryar Ahmad / Kartik Sachar / Christos Gatsogiannis / John C Whitney / Stefan Raunser /   要旨: The type VI secretion system (T6SS) is a widespread protein export apparatus found in Gram-negative bacteria. The majority of T6SSs deliver toxic effector proteins into competitor bacteria. Yet, the ...The type VI secretion system (T6SS) is a widespread protein export apparatus found in Gram-negative bacteria. The majority of T6SSs deliver toxic effector proteins into competitor bacteria. Yet, the structure, function, and activation of many of these effectors remains poorly understood. Here, we present the structures of the T6SS effector RhsA from Pseudomonas protegens and its cognate T6SS spike protein, VgrG1, at 3.3 Å resolution. The structures reveal that the rearrangement hotspot (Rhs) repeats of RhsA assemble into a closed anticlockwise β-barrel spiral similar to that found in bacterial insecticidal Tc toxins and in metazoan teneurin proteins. We find that the C-terminal toxin domain of RhsA is autoproteolytically cleaved but remains inside the Rhs 'cocoon' where, with the exception of three ordered structural elements, most of the toxin is disordered. The N-terminal 'plug' domain is unique to T6SS Rhs proteins and resembles a champagne cork that seals the Rhs cocoon at one end while also mediating interactions with VgrG1. Interestingly, this domain is also autoproteolytically cleaved inside the cocoon but remains associated with it. We propose that mechanical force is required to remove the cleaved part of the plug, resulting in the release of the toxin domain as it is delivered into a susceptible bacterial cell by the T6SS. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13843.map.gz emd_13843.map.gz | 2.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13843-v30.xml emd-13843-v30.xml emd-13843.xml emd-13843.xml | 18.7 KB 18.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_13843_fsc.xml emd_13843_fsc.xml | 18.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_13843.png emd_13843.png | 27.7 KB | ||
| マスクデータ |  emd_13843_msk_1.map emd_13843_msk_1.map | 259.1 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-13843.cif.gz emd-13843.cif.gz | 6.3 KB | ||
| その他 |  emd_13843_half_map_1.map.gz emd_13843_half_map_1.map.gz emd_13843_half_map_2.map.gz emd_13843_half_map_2.map.gz | 125.2 MB 125.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13843 http://ftp.pdbj.org/pub/emdb/structures/EMD-13843 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13843 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13843 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_13843_validation.pdf.gz emd_13843_validation.pdf.gz | 525.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_13843_full_validation.pdf.gz emd_13843_full_validation.pdf.gz | 525.3 KB | 表示 | |
| XML形式データ |  emd_13843_validation.xml.gz emd_13843_validation.xml.gz | 21.9 KB | 表示 | |
| CIF形式データ |  emd_13843_validation.cif.gz emd_13843_validation.cif.gz | 28.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13843 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13843 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13843 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13843 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13843.map.gz / 形式: CCP4 / 大きさ: 259.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13843.map.gz / 形式: CCP4 / 大きさ: 259.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_13843_msk_1.map emd_13843_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_13843_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_13843_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Structure of the VgrG1 trimer from Pseudomonas protegens.
| 全体 | 名称: Structure of the VgrG1 trimer from Pseudomonas protegens. |
|---|---|
| 要素 |
|
-超分子 #1: Structure of the VgrG1 trimer from Pseudomonas protegens.
| 超分子 | 名称: Structure of the VgrG1 trimer from Pseudomonas protegens. タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Pseudomonas protegens Pf-5 (バクテリア) Pseudomonas protegens Pf-5 (バクテリア) |
| 分子量 | 理論値: 215.994 KDa |
-分子 #1: Type VI secretion protein VgrG
| 分子 | 名称: Type VI secretion protein VgrG / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Pseudomonas fluorescens (strain ATCC BAA-477 / NRRL B-23932 / Pf-5) (バクテリア) Pseudomonas fluorescens (strain ATCC BAA-477 / NRRL B-23932 / Pf-5) (バクテリア)株: ATCC BAA-477 / NRRL B-23932 / Pf-5 |
| 分子量 | 理論値: 72.080133 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MLFQQSTRLA QVNCPLGPDV LLLKSLGGGE ELGRLFDYQL QLASSDANID LNQLLGKPMG LSVQLDGGGQ RYFHGIVARC SQNIDTGQF ASYEVTLRPW LWLLSRTSDC RIFQNLSIPQ IIKQVFRDLG FSDFEDALSR PYREWEYCVQ YRETSFDFVS R LMEQEGIY ...文字列: MLFQQSTRLA QVNCPLGPDV LLLKSLGGGE ELGRLFDYQL QLASSDANID LNQLLGKPMG LSVQLDGGGQ RYFHGIVARC SQNIDTGQF ASYEVTLRPW LWLLSRTSDC RIFQNLSIPQ IIKQVFRDLG FSDFEDALSR PYREWEYCVQ YRETSFDFVS R LMEQEGIY YFFRHEKDRH VVVLADAYGA HSSVPGYASV PYYPRDEQQR ERDHMFDWHL AQEVQPGSLE LNDYDFQRPS AR IDVRSAM PRPHSAGDYP LYDYPGTYVQ SSDGEHYAQT RIEALQSLHE RIELSGNARG LGVGNLFSLT GFSRQDQNRE YLI VSIRYY LVQESLESGA GGGSAQFESH LTCIDAQQSF RPLATTHKPM VQGPQTARVV GPAGEEIWTD QYGRVKVHFH WDRH DQSNE NSSCWIRVSQ AWAGKNWGSM QIPRIGQEVI VSFLEGDPDR PIITGRVYNA EQTVPYDLPA NATQSGMKSR SSKGG SPAN FNEIRMEDKK GAEQLYIHAE RNQDIVVEVN ESHSVGNNRN KSIGHDEYVT IGNKRTRIVQ HVDELRVGEK KLDSVG QSY VIEVGERLRL VCGASILELN ASGQINLCGV NISVHASADA QINTGGVLHL NNGGGPGTTT EGQGVQGAIS AKAKAPF SA PKG UniProtKB: Type VI secretion protein VgrG |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| グリッド | モデル: Quantifoil R2/1 / 材質: COPPER / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR / 前処理 - 気圧: 101.325 kPa |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 281 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | The sample was monodisperse. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 70.0 K / 最高: 70.0 K |
| 特殊光学系 | 球面収差補正装置: Cs corrector / エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: INTEGRATING / デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 撮影したグリッド数: 1 / 実像数: 1250 / 平均露光時間: 1.5 sec. / 平均電子線量: 90.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 0.01 mm / 倍率(公称値): 59000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)