+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-12878 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | RNA-free Ribonuclease P from Halorhodospira halophila | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | RNAseP / metallonuclease / HARP / HYDROLASE | |||||||||
| 機能・相同性 | RNA-free ribonuclease P / PINc domain ribonuclease / ribonuclease P / ribonuclease P activity / tRNA 5'-leader removal / PIN-like domain superfamily / RNA-free ribonuclease P 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Halorhodospira halophila SL1 (紅色硫黄細菌) / Halorhodospira halophila SL1 (紅色硫黄細菌) /  Halorhodospira halophila (strain DSM 244 / SL1) (紅色硫黄細菌) Halorhodospira halophila (strain DSM 244 / SL1) (紅色硫黄細菌) | |||||||||
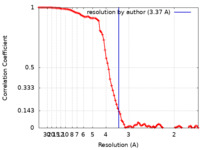
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.37 Å | |||||||||
 データ登録者 データ登録者 | Altegoer F / Bange G | |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2021 ジャーナル: Elife / 年: 2021タイトル: Structure and mechanistic features of the prokaryotic minimal RNase P. 著者: Rebecca Feyh / Nadine B Waeber / Simone Prinz / Pietro Ivan Giammarinaro / Gert Bange / Georg Hochberg / Roland K Hartmann / Florian Altegoer /  要旨: Endonucleolytic removal of 5'-leader sequences from tRNA precursor transcripts (pre-tRNAs) by ribonuclease P (RNase P) is essential for protein synthesis. Beyond RNA-based RNase P enzymes, protein- ...Endonucleolytic removal of 5'-leader sequences from tRNA precursor transcripts (pre-tRNAs) by ribonuclease P (RNase P) is essential for protein synthesis. Beyond RNA-based RNase P enzymes, protein-only versions of the enzyme exert this function in various eukarya (there termed PRORPs) and in some bacteria ( and close relatives); both enzyme types belong to distinct subgroups of the PIN domain metallonuclease superfamily. Homologs of RNase P (HARPs) are also expressed in some other bacteria and many archaea, where they coexist with RNA-based RNase P and do not represent the main RNase P activity. Here, we solved the structure of the bacterial HARP from by cryo-electron microscopy, revealing a novel screw-like dodecameric assembly. Biochemical experiments demonstrate that oligomerization is required for RNase P activity of HARPs. We propose that the tRNA substrate binds to an extended spike-helix (SH) domain that protrudes from the screw-like assembly to position the 5'-end in close proximity to the active site of the neighboring dimer. The structure suggests that eukaryotic PRORPs and prokaryotic HARPs recognize the same structural elements of pre-tRNAs (tRNA elbow region and cleavage site). Our analysis thus delivers the structural and mechanistic basis for pre-tRNA processing by the prokaryotic HARP system. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12878.map.gz emd_12878.map.gz | 33 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12878-v30.xml emd-12878-v30.xml emd-12878.xml emd-12878.xml | 11.3 KB 11.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_12878_fsc.xml emd_12878_fsc.xml | 8.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_12878.png emd_12878.png | 119.9 KB | ||
| Filedesc metadata |  emd-12878.cif.gz emd-12878.cif.gz | 5.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12878 http://ftp.pdbj.org/pub/emdb/structures/EMD-12878 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12878 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12878 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12878_validation.pdf.gz emd_12878_validation.pdf.gz | 560.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12878_full_validation.pdf.gz emd_12878_full_validation.pdf.gz | 559.8 KB | 表示 | |
| XML形式データ |  emd_12878_validation.xml.gz emd_12878_validation.xml.gz | 11 KB | 表示 | |
| CIF形式データ |  emd_12878_validation.cif.gz emd_12878_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12878 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12878 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12878 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12878 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12878.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12878.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.833 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Dodecameric assembly of minimal RNAseP system from Halorhodospira...
| 全体 | 名称: Dodecameric assembly of minimal RNAseP system from Halorhodospira halophila |
|---|---|
| 要素 |
|
-超分子 #1: Dodecameric assembly of minimal RNAseP system from Halorhodospira...
| 超分子 | 名称: Dodecameric assembly of minimal RNAseP system from Halorhodospira halophila タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Halorhodospira halophila SL1 (紅色硫黄細菌) Halorhodospira halophila SL1 (紅色硫黄細菌) |
| 分子量 | 理論値: 390 KDa |
-分子 #1: RNA-free ribonuclease P
| 分子 | 名称: RNA-free ribonuclease P / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO / EC番号: ribonuclease P |
|---|---|
| 由来(天然) | 生物種:  Halorhodospira halophila (strain DSM 244 / SL1) (紅色硫黄細菌) Halorhodospira halophila (strain DSM 244 / SL1) (紅色硫黄細菌)株: DSM 244 / SL1 |
| 分子量 | 理論値: 24.051338 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSHMASRRFV LDTSVFTNPD VYLRFDEEPM QAISVFLGLA RRADAEFYMP GPVYQELCNL RSMDLIGAEF ETEVYIRSPR RFSMTIPSE VLYEFIEEVR TRIQRGLRIA EEHARQAGQA ESLPPELITQ LRERYREAMR RGILDSREDI DVVLLAYELD A TLVSADEG ...文字列: GSHMASRRFV LDTSVFTNPD VYLRFDEEPM QAISVFLGLA RRADAEFYMP GPVYQELCNL RSMDLIGAEF ETEVYIRSPR RFSMTIPSE VLYEFIEEVR TRIQRGLRIA EEHARQAGQA ESLPPELITQ LRERYREAMR RGILDSREDI DVVLLAYELD A TLVSADEG MRKFAERIGI KLVNPRYLRG VMQNLAGDDP GHAPPCGPDQ PAG UniProtKB: RNA-free ribonuclease P |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 8 mg/mL | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 8 構成要素:
詳細: Solutions were prepared freshly and filtered through a 0.2 um filter | |||||||||
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 90 sec. / 前処理 - 雰囲気: AIR | |||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283 K / 装置: FEI VITROBOT MARK IV / 詳細: Blot for 11s with blot force -1 before plunging. | |||||||||
| 詳細 | The sample was monodisperse |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 8393 / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 181 |
|---|---|
| 得られたモデル |  PDB-7og5: |
 ムービー
ムービー コントローラー
コントローラー















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)