+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-12570 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | AL amyloid fibril from a lambda 1 light chain | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | amyloid / antibody / systemic amyloidosis / light chain / IMMUNE SYSTEM | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
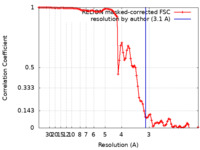
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.1 Å | |||||||||
 データ登録者 データ登録者 | Karimi Farsijani S / Radamaker L | |||||||||
| 資金援助 |  ドイツ, 1件 ドイツ, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Role of mutations and post-translational modifications in systemic AL amyloidosis studied by cryo-EM. 著者: Lynn Radamaker / Sara Karimi-Farsijani / Giada Andreotti / Julian Baur / Matthias Neumann / Sarah Schreiner / Natalie Berghaus / Raoul Motika / Christian Haupt / Paul Walther / Volker Schmidt ...著者: Lynn Radamaker / Sara Karimi-Farsijani / Giada Andreotti / Julian Baur / Matthias Neumann / Sarah Schreiner / Natalie Berghaus / Raoul Motika / Christian Haupt / Paul Walther / Volker Schmidt / Stefanie Huhn / Ute Hegenbart / Stefan O Schönland / Sebastian Wiese / Clarissa Read / Matthias Schmidt / Marcus Fändrich /  要旨: Systemic AL amyloidosis is a rare disease that is caused by the misfolding of immunoglobulin light chains (LCs). Potential drivers of amyloid formation in this disease are post-translational ...Systemic AL amyloidosis is a rare disease that is caused by the misfolding of immunoglobulin light chains (LCs). Potential drivers of amyloid formation in this disease are post-translational modifications (PTMs) and the mutational changes that are inserted into the LCs by somatic hypermutation. Here we present the cryo electron microscopy (cryo-EM) structure of an ex vivo λ1-AL amyloid fibril whose deposits disrupt the ordered cardiomyocyte structure in the heart. The fibril protein contains six mutational changes compared to the germ line and three PTMs (disulfide bond, N-glycosylation and pyroglutamylation). Our data imply that the disulfide bond, glycosylation and mutational changes contribute to determining the fibril protein fold and help to generate a fibril morphology that is able to withstand proteolytic degradation inside the body. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12570.map.gz emd_12570.map.gz | 58.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12570-v30.xml emd-12570-v30.xml emd-12570.xml emd-12570.xml | 17 KB 17 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_12570_fsc.xml emd_12570_fsc.xml | 9.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_12570.png emd_12570.png | 108.7 KB | ||
| Filedesc metadata |  emd-12570.cif.gz emd-12570.cif.gz | 6 KB | ||
| その他 |  emd_12570_half_map_1.map.gz emd_12570_half_map_1.map.gz emd_12570_half_map_2.map.gz emd_12570_half_map_2.map.gz | 52 MB 51.9 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12570 http://ftp.pdbj.org/pub/emdb/structures/EMD-12570 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12570 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12570 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12570_validation.pdf.gz emd_12570_validation.pdf.gz | 739.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12570_full_validation.pdf.gz emd_12570_full_validation.pdf.gz | 739.4 KB | 表示 | |
| XML形式データ |  emd_12570_validation.xml.gz emd_12570_validation.xml.gz | 16.7 KB | 表示 | |
| CIF形式データ |  emd_12570_validation.cif.gz emd_12570_validation.cif.gz | 21.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12570 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12570 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12570 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12570 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7nslMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10730 (タイトル: AL amyloid fibril from a glycosylated lambda 1 light chain EMPIAR-10730 (タイトル: AL amyloid fibril from a glycosylated lambda 1 light chainData size: 495.9 Data #1: Unaligned multi-frame micrographs of AL amyloidosis extracted ex vivo amyloid fibrils patient FOR001 [micrographs - multiframe]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12570.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12570.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.04 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: #2
| ファイル | emd_12570_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
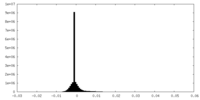
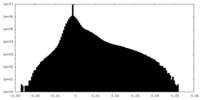
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_12570_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
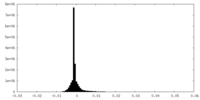
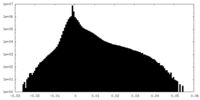
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Amyloid fibril of an antibody lambda 1 immunoglobulin light chain
| 全体 | 名称: Amyloid fibril of an antibody lambda 1 immunoglobulin light chain |
|---|---|
| 要素 |
|
-超分子 #1: Amyloid fibril of an antibody lambda 1 immunoglobulin light chain
| 超分子 | 名称: Amyloid fibril of an antibody lambda 1 immunoglobulin light chain タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all 詳細: Extracted fibrils from the explanted heart of a patient suffering from systemic AL amyloidosis |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: Heart / 組織: Heart muscle Homo sapiens (ヒト) / 器官: Heart / 組織: Heart muscle |
-分子 #1: Amyloid lambda1 light chain
| 分子 | 名称: Amyloid lambda1 light chain / タイプ: protein_or_peptide / ID: 1 / コピー数: 7 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: Heart / 組織: Heart muscle tissue Homo sapiens (ヒト) / 器官: Heart / 組織: Heart muscle tissue |
| 分子量 | 理論値: 12.122354 KDa |
| 配列 | 文字列: QSVLTQPPSV SAAPGQNVTI SCSGSSSNIG NNYVSWYQQL PGTAPKLLIY ETDKRPSGIP DRFSGSKSGT SATLGITGLQ TADEADYYC GTWESSLLAG VFGGGTKLTV LGQPKAAPS |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7 / 構成要素 - 式: H2O / 構成要素 - 名称: Distilled water |
|---|---|
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 40 sec. / 前処理 - 雰囲気: OTHER |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 295 K / 装置: FEI VITROBOT MARK III / 詳細: blot for 9s before plunging. |
| 詳細 | Sample in pure water, pH not determined |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / 撮影したグリッド数: 1 / 実像数: 3032 / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Secondary structure restraints and NCS were applied during refinement |
|---|---|
| 精密化 | 空間: REAL / プロトコル: OTHER 当てはまり具合の基準: REAL-SPACE (WEIGHTED MAP SUM AT ATOM CENTERS) |
| 得られたモデル |  PDB-7nsl: |
 ムービー
ムービー コントローラー
コントローラー














 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)