+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-1221 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Multiple distinct assemblies reveal conformational flexibility in the small heat shock protein Hsp26. | |||||||||
 マップデータ マップデータ | View down the 2-fold axis of the expanded form of yeast Hsp26 | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報response to salt stress / response to hydrogen peroxide / protein homooligomerization / : / unfolded protein binding / protein folding / protein complex oligomerization / response to heat / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 10.8 Å | |||||||||
 データ登録者 データ登録者 | White HE / Orlova EV / Chen S / Wang L / Ignatiou A / Gowen B / Stromer T / Franzmann TM / Haslbeck M / Buchner J / Saibil HR | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2006 ジャーナル: Structure / 年: 2006タイトル: Multiple distinct assemblies reveal conformational flexibility in the small heat shock protein Hsp26. 著者: Helen E White / Elena V Orlova / Shaoxia Chen / Luchun Wang / Athanasios Ignatiou / Brent Gowen / Thusnelda Stromer / Titus M Franzmann / Martin Haslbeck / Johannes Buchner / Helen R Saibil /  要旨: Small heat shock proteins are a superfamily of molecular chaperones that suppress protein aggregation and provide protection from cell stress. A key issue for understanding their action is to define ...Small heat shock proteins are a superfamily of molecular chaperones that suppress protein aggregation and provide protection from cell stress. A key issue for understanding their action is to define the interactions of subunit domains in these oligomeric assemblies. Cryo-electron microscopy of yeast Hsp26 reveals two distinct forms, each comprising 24 subunits arranged in a porous shell with tetrahedral symmetry. The subunits form elongated, asymmetric dimers that assemble via trimeric contacts. Modifications of both termini cause rearrangements that yield a further four assemblies. Each subunit contains an N-terminal region, a globular middle domain, the alpha-crystallin domain, and a C-terminal tail. Twelve of the C termini form 3-fold assembly contacts which are inserted into the interior of the shell, while the other 12 C termini form contacts on the surface. Hinge points between the domains allow a variety of assembly contacts, providing the flexibility required for formation of supercomplexes with non-native proteins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_1221.map.gz emd_1221.map.gz | 1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-1221-v30.xml emd-1221-v30.xml emd-1221.xml emd-1221.xml | 9.2 KB 9.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  1221.gif 1221.gif | 54.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-1221 http://ftp.pdbj.org/pub/emdb/structures/EMD-1221 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1221 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-1221 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_1221_validation.pdf.gz emd_1221_validation.pdf.gz | 312.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_1221_full_validation.pdf.gz emd_1221_full_validation.pdf.gz | 312.4 KB | 表示 | |
| XML形式データ |  emd_1221_validation.xml.gz emd_1221_validation.xml.gz | 5.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1221 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1221 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1221 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-1221 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_1221.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_1221.map.gz / 形式: CCP4 / 大きさ: 7.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | View down the 2-fold axis of the expanded form of yeast Hsp26 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.86 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
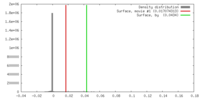
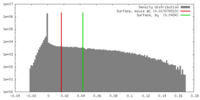
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : yeast small heat shock protein 26
| 全体 | 名称: yeast small heat shock protein 26 |
|---|---|
| 要素 |
|
-超分子 #1000: yeast small heat shock protein 26
| 超分子 | 名称: yeast small heat shock protein 26 / タイプ: sample / ID: 1000 / 集合状態: 24-mer / Number unique components: 1 |
|---|
-分子 #1: Hsp26
| 分子 | 名称: Hsp26 / タイプ: protein_or_peptide / ID: 1 / 集合状態: 24-mer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.0 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 詳細: 40 mM Hepes, 50 mM NaCl, 2 mM EDTA, 1 mM DTT |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM200FEG |
|---|---|
| 撮影 | カテゴリ: FILM / フィルム・検出器のモデル: KODAK SO-163 FILM / デジタル化 - スキャナー: ZEISS SCAI / デジタル化 - サンプリング間隔: 1.86 µm / 実像数: 21 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 36080 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.4 µm / 最小 デフォーカス(公称値): 2.0 µm / 倍率(公称値): 38000 |
| 試料ステージ | 試料ホルダー: Eucentric / 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
| CTF補正 | 詳細: Phase flipping |
|---|---|
| 最終 再構成 | 想定した対称性 - 点群: T (正4面体型対称) / アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 10.8 Å / 解像度の算出法: FSC 0.5 CUT-OFF / ソフトウェア - 名称: Imagic / 詳細: Angular reconstitution / 使用した粒子像数: 10000 |
| 最終 2次元分類 | クラス数: 1300 |
 ムービー
ムービー コントローラー
コントローラー













 Z (Sec.)
Z (Sec.) X (Row.)
X (Row.) Y (Col.)
Y (Col.)