[English] 日本語
 Yorodumi
Yorodumi- PDB-7k52: Near post-translocated non-frameshifting(CCA-A) complex with EF-G... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 7k52 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Title | Near post-translocated non-frameshifting(CCA-A) complex with EF-G and GDPCP (Structure III) | ||||||||||||
 Components Components |
| ||||||||||||
 Keywords Keywords | RIBOSOME / EF-G / tRNA / TRANSLATION | ||||||||||||
| Function / homology |  Function and homology information Function and homology informationguanosine tetraphosphate binding / negative regulation of cytoplasmic translational initiation / stringent response / transcription antitermination factor activity, RNA binding / ornithine decarboxylase inhibitor activity / misfolded RNA binding / Group I intron splicing / RNA folding / transcriptional attenuation / endoribonuclease inhibitor activity ...guanosine tetraphosphate binding / negative regulation of cytoplasmic translational initiation / stringent response / transcription antitermination factor activity, RNA binding / ornithine decarboxylase inhibitor activity / misfolded RNA binding / Group I intron splicing / RNA folding / transcriptional attenuation / endoribonuclease inhibitor activity / translation elongation factor activity / positive regulation of ribosome biogenesis / RNA-binding transcription regulator activity / translational termination / negative regulation of cytoplasmic translation / four-way junction DNA binding / DnaA-L2 complex / translation repressor activity / negative regulation of translational initiation / regulation of mRNA stability / negative regulation of DNA-templated DNA replication initiation / mRNA regulatory element binding translation repressor activity / positive regulation of RNA splicing / assembly of large subunit precursor of preribosome / cytosolic ribosome assembly / response to reactive oxygen species / regulation of DNA-templated transcription elongation / ribosome assembly / transcription elongation factor complex / transcription antitermination / DNA endonuclease activity / regulation of cell growth / translational initiation / DNA-templated transcription termination / response to radiation / maintenance of translational fidelity / mRNA 5'-UTR binding / regulation of translation / large ribosomal subunit / ribosome biogenesis / transferase activity / ribosome binding / ribosomal small subunit biogenesis / ribosomal small subunit assembly / ribosomal large subunit assembly / 5S rRNA binding / small ribosomal subunit / small ribosomal subunit rRNA binding / cytosolic small ribosomal subunit / large ribosomal subunit rRNA binding / cytosolic large ribosomal subunit / cytoplasmic translation / tRNA binding / negative regulation of translation / rRNA binding / structural constituent of ribosome / ribosome / translation / hydrolase activity / response to antibiotic / negative regulation of DNA-templated transcription / GTPase activity / mRNA binding / GTP binding / DNA binding / RNA binding / zinc ion binding / membrane / cytoplasm / cytosol Similarity search - Function | ||||||||||||
| Biological species |  | ||||||||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 3.4 Å | ||||||||||||
 Authors Authors | Demo, G. / Loveland, A.B. / Svidritskiy, E. / Gamper, H.B. / Hou, Y.M. / Korostelev, A.A. | ||||||||||||
| Funding support |  United States, United States,  Czech Republic, 3items Czech Republic, 3items
| ||||||||||||
 Citation Citation |  Journal: Nat Commun / Year: 2021 Journal: Nat Commun / Year: 2021Title: Structural basis for +1 ribosomal frameshifting during EF-G-catalyzed translocation. Authors: Gabriel Demo / Howard B Gamper / Anna B Loveland / Isao Masuda / Christine E Carbone / Egor Svidritskiy / Ya-Ming Hou / Andrei A Korostelev /   Abstract: Frameshifting of mRNA during translation provides a strategy to expand the coding repertoire of cells and viruses. How and where in the elongation cycle +1-frameshifting occurs remains poorly ...Frameshifting of mRNA during translation provides a strategy to expand the coding repertoire of cells and viruses. How and where in the elongation cycle +1-frameshifting occurs remains poorly understood. We describe seven ~3.5-Å-resolution cryo-EM structures of 70S ribosome complexes, allowing visualization of elongation and translocation by the GTPase elongation factor G (EF-G). Four structures with a + 1-frameshifting-prone mRNA reveal that frameshifting takes place during translocation of tRNA and mRNA. Prior to EF-G binding, the pre-translocation complex features an in-frame tRNA-mRNA pairing in the A site. In the partially translocated structure with EF-G•GDPCP, the tRNA shifts to the +1-frame near the P site, rendering the freed mRNA base to bulge between the P and E sites and to stack on the 16S rRNA nucleotide G926. The ribosome remains frameshifted in the nearly post-translocation state. Our findings demonstrate that the ribosome and EF-G cooperate to induce +1 frameshifting during tRNA-mRNA translocation. | ||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  7k52.cif.gz 7k52.cif.gz | 3.3 MB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb7k52.ent.gz pdb7k52.ent.gz | Display |  PDB format PDB format | |
| PDBx/mmJSON format |  7k52.json.gz 7k52.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/k5/7k52 https://data.pdbj.org/pub/pdb/validation_reports/k5/7k52 ftp://data.pdbj.org/pub/pdb/validation_reports/k5/7k52 ftp://data.pdbj.org/pub/pdb/validation_reports/k5/7k52 | HTTPS FTP |
|---|
-Related structure data
| Related structure data |  22671MC  7k50C  7k51C  7k53C  7k54C  7k55C  7lv0C M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
+50S ribosomal protein ... , 32 types, 32 molecules bcdefghijklmnopqrstuvwxyzABCDEFa
-30S ribosomal protein ... , 20 types, 20 molecules GHIJKLMNOPQRSTUVWXYZ
| #32: Protein | Mass: 25015.816 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
|---|---|
| #33: Protein | Mass: 23078.785 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #34: Protein | Mass: 23383.002 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #35: Protein | Mass: 16532.088 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #36: Protein | Mass: 11669.371 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #37: Protein | Mass: 16861.523 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #38: Protein | Mass: 14015.361 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #39: Protein | Mass: 14554.882 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #40: Protein | Mass: 11196.988 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #41: Protein | Mass: 12388.068 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #42: Protein | Mass: 13636.961 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #43: Protein | Mass: 12625.753 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #44: Protein | Mass: 11475.364 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #45: Protein | Mass: 10159.621 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #46: Protein | Mass: 9207.572 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #47: Protein | Mass: 9263.946 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #48: Protein | Mass: 7606.768 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #49: Protein | Mass: 9057.626 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #50: Protein | Mass: 9506.190 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #51: Protein | Mass: 7763.073 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
-RNA chain , 6 types, 6 molecules 312564
| #53: RNA chain | Mass: 498725.406 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
|---|---|
| #54: RNA chain | Mass: 941305.250 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #55: RNA chain | Mass: 38813.133 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #56: RNA chain | Mass: 24862.746 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Details: cell / Source: (natural)  |
| #57: RNA chain | Mass: 24802.785 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
| #58: RNA chain | Mass: 5192.207 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.)  |
-Protein , 1 types, 1 molecules 8
| #59: Protein | Mass: 78616.203 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Production host:  References: UniProt: U9XYS4 |
|---|
-Non-polymers , 4 types, 4 molecules 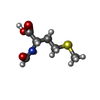
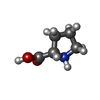




| #60: Chemical | ChemComp-FME / |
|---|---|
| #61: Chemical | ChemComp-PRO / |
| #62: Chemical | ChemComp-GCP / |
| #63: Chemical | ChemComp-MG / |
-Details
| Has ligand of interest | Y |
|---|
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: Near post-translocated non-frameshifting(CCA-A) ribosome complex Type: RIBOSOME / Entity ID: #1-#59 / Source: NATURAL | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Molecular weight | Value: 1.6 MDa / Experimental value: NO | |||||||||||||||||||||||||||||||||||
| Source (natural) | Organism:  | |||||||||||||||||||||||||||||||||||
| Buffer solution | pH: 7.5 | |||||||||||||||||||||||||||||||||||
| Buffer component |
| |||||||||||||||||||||||||||||||||||
| Specimen | Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES | |||||||||||||||||||||||||||||||||||
| Specimen support | Details: glow discharged with 25mA negative polarity in PELCO easiGlow unit Grid material: COPPER / Grid mesh size: 200 divisions/in. / Grid type: Quantifoil R2/1 | |||||||||||||||||||||||||||||||||||
| Vitrification | Instrument: FEI VITROBOT MARK IV / Cryogen name: ETHANE / Humidity: 95 % / Chamber temperature: 278 K / Details: blotting force 9, blotted for 4 seconds |
- Electron microscopy imaging
Electron microscopy imaging
| Experimental equipment |  Model: Titan Krios / Image courtesy: FEI Company |
|---|---|
| Microscopy | Model: FEI TITAN KRIOS |
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 300 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal magnification: 130000 X / Nominal defocus max: 2000 nm / Nominal defocus min: 800 nm / Alignment procedure: COMA FREE |
| Specimen holder | Cryogen: NITROGEN / Specimen holder model: FEI TITAN KRIOS AUTOGRID HOLDER |
| Image recording | Average exposure time: 7.2 sec. / Electron dose: 47.5 e/Å2 / Detector mode: SUPER-RESOLUTION / Film or detector model: GATAN K2 SUMMIT (4k x 4k) / Num. of real images: 1041 |
| Image scans | Movie frames/image: 36 / Used frames/image: 1-36 |
- Processing
Processing
| EM software |
| |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION | |||||||||||||||||||||||||||||||||||
| Particle selection | Num. of particles selected: 62716 | |||||||||||||||||||||||||||||||||||
| Symmetry | Point symmetry: C1 (asymmetric) | |||||||||||||||||||||||||||||||||||
| 3D reconstruction | Resolution: 3.4 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 4612 / Symmetry type: POINT | |||||||||||||||||||||||||||||||||||
| Atomic model building | Protocol: FLEXIBLE FIT / Space: REAL / Target criteria: correlation coefficient | |||||||||||||||||||||||||||||||||||
| Atomic model building |
|
 Movie
Movie Controller
Controller




























 PDBj
PDBj






































