+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 7d7m | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM Structure of the Prostaglandin E Receptor EP4 Coupled to G Protein | ||||||||||||||||||
 要素 要素 |
| ||||||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / prostaglandin E receptor / EP4 / GPCR / G protein | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of eosinophil extravasation / prostaglandin E receptor activity / negative regulation of integrin activation / Prostanoid ligand receptors / T-helper cell differentiation / regulation of stress fiber assembly / negative regulation of cytokine production / PKA activation in glucagon signalling / developmental growth / hair follicle placode formation ...negative regulation of eosinophil extravasation / prostaglandin E receptor activity / negative regulation of integrin activation / Prostanoid ligand receptors / T-helper cell differentiation / regulation of stress fiber assembly / negative regulation of cytokine production / PKA activation in glucagon signalling / developmental growth / hair follicle placode formation / D1 dopamine receptor binding / response to mechanical stimulus / intracellular transport / vascular endothelial cell response to laminar fluid shear stress / renal water homeostasis / activation of adenylate cyclase activity / Hedgehog 'off' state / adenylate cyclase-activating adrenergic receptor signaling pathway / JNK cascade / response to prostaglandin E / ERK1 and ERK2 cascade / regulation of insulin secretion / cellular response to glucagon stimulus / adenylate cyclase activator activity / positive regulation of cytokine production / trans-Golgi network membrane / negative regulation of inflammatory response to antigenic stimulus / cellular response to mechanical stimulus / bone development / adenylate cyclase-inhibiting G protein-coupled receptor signaling pathway / negative regulation of inflammatory response / platelet aggregation / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / cognition / G-protein beta/gamma-subunit complex binding / Olfactory Signaling Pathway / Activation of the phototransduction cascade / adenylate cyclase-activating G protein-coupled receptor signaling pathway / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / G protein-coupled acetylcholine receptor signaling pathway / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / G-protein activation / positive regulation of inflammatory response / G beta:gamma signalling through CDC42 / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / ADP signalling through P2Y purinoceptor 12 / photoreceptor disc membrane / Sensory perception of sweet, bitter, and umami (glutamate) taste / Glucagon-type ligand receptors / Adrenaline,noradrenaline inhibits insulin secretion / Vasopressin regulates renal water homeostasis via Aquaporins / sensory perception of smell / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / G alpha (z) signalling events / ADP signalling through P2Y purinoceptor 1 / cellular response to catecholamine stimulus / ADORA2B mediated anti-inflammatory cytokines production / G beta:gamma signalling through PI3Kgamma / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / adenylate cyclase-activating dopamine receptor signaling pathway / GPER1 signaling / Inactivation, recovery and regulation of the phototransduction cascade / G-protein beta-subunit binding / cellular response to prostaglandin E stimulus / heterotrimeric G-protein complex / G alpha (12/13) signalling events / sensory perception of taste / extracellular vesicle / positive regulation of cold-induced thermogenesis / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / positive regulation of cytosolic calcium ion concentration / retina development in camera-type eye / G protein activity / GTPase binding / Ca2+ pathway / fibroblast proliferation / High laminar flow shear stress activates signaling by PIEZO1 and PECAM1:CDH5:KDR in endothelial cells / G alpha (i) signalling events / G alpha (s) signalling events / phospholipase C-activating G protein-coupled receptor signaling pathway / G alpha (q) signalling events / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / Ras protein signal transduction / Extra-nuclear estrogen signaling / cell population proliferation / immune response / G protein-coupled receptor signaling pathway / inflammatory response / lysosomal membrane / GTPase activity / synapse / GTP binding / protein-containing complex binding 類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Nojima, S. / Fujita, Y. / Kimura, T.K. / Nomura, N. / Suno, R. / Morimoto, K. / Yamamoto, M. / Noda, T. / Iwata, S. / Shigematsu, H. / Kobayashi, T. | ||||||||||||||||||
| 資金援助 |  日本, 5件 日本, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2021 ジャーナル: Structure / 年: 2021タイトル: Cryo-EM Structure of the Prostaglandin E Receptor EP4 Coupled to G Protein. 著者: Shingo Nojima / Yoko Fujita / Kanako Terakado Kimura / Norimichi Nomura / Ryoji Suno / Kazushi Morimoto / Masaki Yamamoto / Takeshi Noda / So Iwata / Hideki Shigematsu / Takuya Kobayashi /  要旨: Prostaglandin E receptor EP4, a class A G protein-coupled receptor (GPCR), is a common drug target in various disorders, such as acute decompensated heart failure and ulcerative colitis. Here, we ...Prostaglandin E receptor EP4, a class A G protein-coupled receptor (GPCR), is a common drug target in various disorders, such as acute decompensated heart failure and ulcerative colitis. Here, we report the cryoelectron microscopy (cryo-EM) structure of the EP4-heterotrimeric G protein (Gs) complex with the endogenous ligand at a global resolution of 3.3 Å. In this structure, compared with that in the inactive EP4 structure, the sixth transmembrane domain is shifted outward on the intracellular side, although the shift is smaller than that in other class A GPCRs bound to Gs. Instead, the C-terminal helix of Gs is inserted toward TM2 of EP4, and the conserved C-terminal hook structure formsthe extended state. These structural features are formed by the conserved residues in prostanoid receptors (Phe54 and Trp327). These findings may be important for the thorough understanding of the G protein-binding mechanism of EP4 and other prostanoid receptors. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  7d7m.cif.gz 7d7m.cif.gz | 205.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb7d7m.ent.gz pdb7d7m.ent.gz | 151.4 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  7d7m.json.gz 7d7m.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  7d7m_validation.pdf.gz 7d7m_validation.pdf.gz | 1.3 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  7d7m_full_validation.pdf.gz 7d7m_full_validation.pdf.gz | 1.3 MB | 表示 | |
| XML形式データ |  7d7m_validation.xml.gz 7d7m_validation.xml.gz | 42.2 KB | 表示 | |
| CIF形式データ |  7d7m_validation.cif.gz 7d7m_validation.cif.gz | 63.5 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/d7/7d7m https://data.pdbj.org/pub/pdb/validation_reports/d7/7d7m ftp://data.pdbj.org/pub/pdb/validation_reports/d7/7d7m ftp://data.pdbj.org/pub/pdb/validation_reports/d7/7d7m | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-Guanine nucleotide-binding protein ... , 3種, 3分子 BCD
| #2: タンパク質 | 分子量: 37728.152 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNB1 / プラスミド: pFastBac Dual Homo sapiens (ヒト) / 遺伝子: GNB1 / プラスミド: pFastBac Dual発現宿主:  参照: UniProt: P62873 |
|---|---|
| #3: タンパク質 | 分子量: 7861.143 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNG2 / プラスミド: pFastBac Dual Homo sapiens (ヒト) / 遺伝子: GNG2 / プラスミド: pFastBac Dual発現宿主:  参照: UniProt: P59768 |
| #4: タンパク質 | 分子量: 29014.750 Da / 分子数: 1 変異: 65 to 203, 255 to 264 deletion G49D, E50N, L63Y, A249D, S252D, I372A and V375I 由来タイプ: 組換発現 詳細: residues from 65 to 203, residues from 255 to 264 were deleted 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: GNAS, GNAS1, GSP / プラスミド: pET21a / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GNAS, GNAS1, GSP / プラスミド: pET21a / 発現宿主:  |
-タンパク質 / 抗体 / 非ポリマー , 3種, 3分子 AE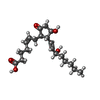

| #1: タンパク質 | 分子量: 36953.453 Da / 分子数: 1 / 変異: N7Q, N177Q, 218-259 deletion / 由来タイプ: 組換発現 / 詳細: residues from 218 to 259 were deleted / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: PTGER4, PTGER2 / プラスミド: pFastBac1 Homo sapiens (ヒト) / 遺伝子: PTGER4, PTGER2 / プラスミド: pFastBac1発現宿主:  参照: UniProt: P35408 |
|---|---|
| #5: 抗体 | 分子量: 14680.293 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: The C-terminal "ENLYFQ" of sample sequence is a cleavaged TEV protease recognition sequence. 由来: (組換発現)   Brevibacillus choshinensis (バクテリア) Brevibacillus choshinensis (バクテリア) |
| #6: 化合物 | ChemComp-P2E / ( |
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: 2D ARRAY / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.12 MDa / 実験値: YES | |||||||||||||||||||||||||||||||||||
| 由来(天然) |
| |||||||||||||||||||||||||||||||||||
| 由来(組換発現) |
| |||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | |||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 8.4 mg/ml / 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES | |||||||||||||||||||||||||||||||||||
| 試料支持 | 詳細: 10 mA / グリッドの材料: COPPER / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R0.6/1 | |||||||||||||||||||||||||||||||||||
| 急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 281 K / 詳細: Blot Force 10, Blot Time 3.5 sec, 3 microL apply |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 1800 nm / 最小 デフォーカス(公称値): 600 nm / Cs: 2.7 mm / C2レンズ絞り径: 50 µm / アライメント法: ZEMLIN TABLEAU |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER Residual tilt: 0.01 mradians |
| 撮影 | 平均露光時間: 1.83 sec. / 電子線照射量: 50 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 1 / 実像数: 5743 |
| 電子光学装置 | エネルギーフィルター名称: GIF Bioquantum / エネルギーフィルタースリット幅: 25 eV |
| 画像スキャン | サンプリングサイズ: 5 µm / 横: 4092 / 縦: 5760 |
- 解析
解析
| EMソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING ONLY | |||||||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 2796263 | |||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性: C1 (非対称) | |||||||||||||||||||||||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.3 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 178217 / アルゴリズム: FOURIER SPACE / クラス平均像の数: 1 / 対称性のタイプ: POINT | |||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | |||||||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | 3D fitting-ID: 1 / Source name: PDB / タイプ: experimental model
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj


























