[English] 日本語
 Yorodumi
Yorodumi- PDB-7axn: 14-3-3 sigma in complex with Pin1 binding site pS72 and covalentl... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 7axn | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | 14-3-3 sigma in complex with Pin1 binding site pS72 and covalently bound TCF521-026 | |||||||||
 Components Components |
| |||||||||
 Keywords Keywords | PEPTIDE BINDING PROTEIN / 1433 / Peptidyl-prolyl cis-trans isomerase NIMA-interacting 1 | |||||||||
| Function / homology |  Function and homology information Function and homology informationcis-trans isomerase activity / phosphothreonine residue binding / negative regulation of cell motility / ubiquitin ligase activator activity / regulation of protein localization to nucleus / GTPase activating protein binding / mitogen-activated protein kinase kinase binding / : / protein peptidyl-prolyl isomerization / regulation of mitotic nuclear division ...cis-trans isomerase activity / phosphothreonine residue binding / negative regulation of cell motility / ubiquitin ligase activator activity / regulation of protein localization to nucleus / GTPase activating protein binding / mitogen-activated protein kinase kinase binding / : / protein peptidyl-prolyl isomerization / regulation of mitotic nuclear division / regulation of epidermal cell division / protein kinase C inhibitor activity / positive regulation of epidermal cell differentiation / keratinocyte development / keratinization / negative regulation of SMAD protein signal transduction / PI5P Regulates TP53 Acetylation / regulation of cell-cell adhesion / negative regulation of amyloid-beta formation / cytoskeletal motor activity / cAMP/PKA signal transduction / Regulation of localization of FOXO transcription factors / keratinocyte proliferation / RHO GTPases Activate NADPH Oxidases / Activation of BAD and translocation to mitochondria / phosphoserine residue binding / negative regulation of keratinocyte proliferation / establishment of skin barrier / negative regulation of protein localization to plasma membrane / postsynaptic cytosol / Chk1/Chk2(Cds1) mediated inactivation of Cyclin B:Cdk1 complex / SARS-CoV-2 targets host intracellular signalling and regulatory pathways / negative regulation of protein kinase activity / negative regulation of stem cell proliferation / Rho protein signal transduction / RHO GTPases activate PKNs / SARS-CoV-1 targets host intracellular signalling and regulatory pathways / negative regulation of protein binding / positive regulation of protein localization / positive regulation of cell adhesion / protein sequestering activity / negative regulation of innate immune response / TP53 Regulates Transcription of Genes Involved in G2 Cell Cycle Arrest / protein export from nucleus / release of cytochrome c from mitochondria / stem cell proliferation / positive regulation of protein export from nucleus / regulation of cytokinesis / TP53 Regulates Metabolic Genes / Translocation of SLC2A4 (GLUT4) to the plasma membrane / peptidylprolyl isomerase / peptidyl-prolyl cis-trans isomerase activity / Negative regulators of DDX58/IFIH1 signaling / phosphoprotein binding / negative regulation of transforming growth factor beta receptor signaling pathway / synapse organization / beta-catenin binding / negative regulation of protein catabolic process / regulation of protein stability / negative regulation of ERK1 and ERK2 cascade / ISG15 antiviral mechanism / tau protein binding / intrinsic apoptotic signaling pathway in response to DNA damage / neuron differentiation / positive regulation of protein phosphorylation / intracellular protein localization / positive regulation of canonical Wnt signaling pathway / regulation of protein localization / regulation of gene expression / positive regulation of cell growth / midbody / cellular response to hypoxia / Regulation of TP53 Activity through Phosphorylation / response to hypoxia / regulation of cell cycle / protein stabilization / nuclear speck / ciliary basal body / cadherin binding / protein kinase binding / glutamatergic synapse / negative regulation of transcription by RNA polymerase II / signal transduction / positive regulation of transcription by RNA polymerase II / extracellular space / extracellular exosome / nucleoplasm / identical protein binding / nucleus / cytosol / cytoplasm Similarity search - Function | |||||||||
| Biological species |  Homo sapiens (human) Homo sapiens (human) | |||||||||
| Method |  X-RAY DIFFRACTION / X-RAY DIFFRACTION /  SYNCHROTRON / SYNCHROTRON /  MOLECULAR REPLACEMENT / MOLECULAR REPLACEMENT /  molecular replacement / Resolution: 1.4 Å molecular replacement / Resolution: 1.4 Å | |||||||||
 Authors Authors | Wolter, M. / Dijck, L.v. / Ottmann, C. | |||||||||
| Funding support | 2items
| |||||||||
 Citation Citation |  Journal: J.Am.Chem.Soc. / Year: 2021 Journal: J.Am.Chem.Soc. / Year: 2021Title: Reversible Covalent Imine-Tethering for Selective Stabilization of 14-3-3 Hub Protein Interactions. Authors: Cossar, P.J. / Wolter, M. / van Dijck, L. / Valenti, D. / Levy, L.M. / Ottmann, C. / Brunsveld, L. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  7axn.cif.gz 7axn.cif.gz | 77.8 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb7axn.ent.gz pdb7axn.ent.gz | 55 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  7axn.json.gz 7axn.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  7axn_validation.pdf.gz 7axn_validation.pdf.gz | 562.9 KB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  7axn_full_validation.pdf.gz 7axn_full_validation.pdf.gz | 563.2 KB | Display | |
| Data in XML |  7axn_validation.xml.gz 7axn_validation.xml.gz | 15.1 KB | Display | |
| Data in CIF |  7axn_validation.cif.gz 7axn_validation.cif.gz | 23.2 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/ax/7axn https://data.pdbj.org/pub/pdb/validation_reports/ax/7axn ftp://data.pdbj.org/pub/pdb/validation_reports/ax/7axn ftp://data.pdbj.org/pub/pdb/validation_reports/ax/7axn | HTTPS FTP |
-Related structure data
| Related structure data |  7aogSC  7ayfC  7az1C  7az2C  7bdpC  7bdtC  7bdyC  7bfwC  7bg3C  7bgqC  7bgrC  7bgvC  7bgwC  7nifC  7nigC  7nixC  7nj6C  7nj8C  7njaC  7nqpC  7nrkC  7nrlC  7nsvC S: Starting model for refinement C: citing same article ( |
|---|---|
| Similar structure data |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| Unit cell |
| ||||||||
| Components on special symmetry positions |
|
- Components
Components
-Protein / Protein/peptide , 2 types, 2 molecules AP
| #1: Protein | Mass: 28226.518 Da / Num. of mol.: 1 Source method: isolated from a genetically manipulated source Source: (gene. exp.)  Homo sapiens (human) / Gene: SFN, HME1 / Production host: Homo sapiens (human) / Gene: SFN, HME1 / Production host:  |
|---|---|
| #2: Protein/peptide | Mass: 2195.378 Da / Num. of mol.: 1 / Source method: obtained synthetically / Source: (synth.)  Homo sapiens (human) / References: UniProt: Q13526, peptidylprolyl isomerase Homo sapiens (human) / References: UniProt: Q13526, peptidylprolyl isomerase |
-Non-polymers , 4 types, 346 molecules 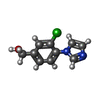






| #3: Chemical | ChemComp-S6B / | ||||
|---|---|---|---|---|---|
| #4: Chemical | ChemComp-CA / #5: Chemical | ChemComp-CL / | #6: Water | ChemComp-HOH / | |
-Details
| Has ligand of interest | Y |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method:  X-RAY DIFFRACTION / Number of used crystals: 1 X-RAY DIFFRACTION / Number of used crystals: 1 |
|---|
- Sample preparation
Sample preparation
| Crystal | Density Matthews: 2.4 Å3/Da / Density % sol: 48.69 % |
|---|---|
| Crystal grow | Temperature: 277 K / Method: vapor diffusion, hanging drop / pH: 7.1 Details: 0.095 M HEPES Na pH 7.1, 27% PEG400, 0.19M Calcium chloride, 5% Glycerol |
-Data collection
| Diffraction | Mean temperature: 100 K / Serial crystal experiment: N | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Diffraction source | Source:  SYNCHROTRON / Site: SYNCHROTRON / Site:  Diamond Diamond  / Beamline: I03 / Wavelength: 0.97625 Å / Beamline: I03 / Wavelength: 0.97625 Å | ||||||||||||||||||||||||||||||
| Detector | Type: DECTRIS EIGER2 XE 16M / Detector: PIXEL / Date: Sep 15, 2019 | ||||||||||||||||||||||||||||||
| Radiation | Protocol: SINGLE WAVELENGTH / Monochromatic (M) / Laue (L): M / Scattering type: x-ray | ||||||||||||||||||||||||||||||
| Radiation wavelength | Wavelength: 0.97625 Å / Relative weight: 1 | ||||||||||||||||||||||||||||||
| Reflection | Resolution: 1.4→66.16 Å / Num. obs: 54952 / % possible obs: 96.6 % / Redundancy: 1.9 % / Biso Wilson estimate: 15.67 Å2 / CC1/2: 1 / Rmerge(I) obs: 0.014 / Rpim(I) all: 0.014 / Rrim(I) all: 0.02 / Net I/σ(I): 16.2 | ||||||||||||||||||||||||||||||
| Reflection shell | Diffraction-ID: 1
|
-Phasing
| Phasing | Method:  molecular replacement molecular replacement |
|---|
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Refinement | Method to determine structure:  MOLECULAR REPLACEMENT MOLECULAR REPLACEMENTStarting model: 7AOG Resolution: 1.4→55.97 Å / SU ML: 0.13 / Cross valid method: FREE R-VALUE / σ(F): 1.36 / Phase error: 19.06 / Stereochemistry target values: ML
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | Shrinkage radii: 0.9 Å / VDW probe radii: 1.11 Å / Solvent model: FLAT BULK SOLVENT MODEL | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso max: 91.56 Å2 / Biso mean: 22.1579 Å2 / Biso min: 11.23 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: final / Resolution: 1.4→55.97 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0
|
 Movie
Movie Controller
Controller











 PDBj
PDBj














