+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6m2w | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of RyR1 (Ca2+/Caffeine/ATP/CaM1234/CHL) | |||||||||||||||
 要素 要素 |
| |||||||||||||||
 キーワード キーワード | MEMBRANE PROTEIN / Rabbit / Ryanodine receptor1 / CHL. | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-gated ion channel activity / positive regulation of sequestering of calcium ion / cyclic nucleotide binding / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / negative regulation of release of sequestered calcium ion into cytosol / terminal cisterna / neuronal action potential propagation / ryanodine receptor complex / insulin secretion involved in cellular response to glucose stimulus ...ATP-gated ion channel activity / positive regulation of sequestering of calcium ion / cyclic nucleotide binding / negative regulation of calcium-mediated signaling / negative regulation of insulin secretion involved in cellular response to glucose stimulus / negative regulation of release of sequestered calcium ion into cytosol / terminal cisterna / neuronal action potential propagation / ryanodine receptor complex / insulin secretion involved in cellular response to glucose stimulus / CaM pathway / ryanodine-sensitive calcium-release channel activity / Cam-PDE 1 activation / Sodium/Calcium exchangers / release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / Calmodulin induced events / response to redox state / Reduction of cytosolic Ca++ levels / protein maturation by protein folding / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / Activation of Ca-permeable Kainate Receptor / ossification involved in bone maturation / Loss of phosphorylation of MECP2 at T308 / 'de novo' protein folding / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation / negative regulation of high voltage-gated calcium channel activity / CaMK IV-mediated phosphorylation of CREB / Glycogen breakdown (glycogenolysis) / positive regulation of cyclic-nucleotide phosphodiesterase activity / organelle localization by membrane tethering / negative regulation of heart rate / negative regulation of calcium ion export across plasma membrane / CLEC7A (Dectin-1) induces NFAT activation / autophagosome membrane docking / mitochondrion-endoplasmic reticulum membrane tethering / Activation of RAC1 downstream of NMDARs / regulation of cardiac muscle cell action potential / skin development / FK506 binding / positive regulation of ryanodine-sensitive calcium-release channel activity / organelle membrane / positive regulation of axon regeneration / regulation of cell communication by electrical coupling involved in cardiac conduction / Synthesis of IP3 and IP4 in the cytosol / negative regulation of peptidyl-threonine phosphorylation / Negative regulation of NMDA receptor-mediated neuronal transmission / Phase 0 - rapid depolarisation / Unblocking of NMDA receptors, glutamate binding and activation / negative regulation of ryanodine-sensitive calcium-release channel activity / cellular response to caffeine / channel regulator activity / protein phosphatase activator activity / RHO GTPases activate PAKs / outflow tract morphogenesis / intracellularly gated calcium channel activity / Ion transport by P-type ATPases / : / Uptake and function of anthrax toxins / Long-term potentiation / Calcineurin activates NFAT / Regulation of MECP2 expression and activity / catalytic complex / DARPP-32 events / detection of calcium ion / regulation of cardiac muscle contraction / smooth muscle contraction / Smooth Muscle Contraction / response to vitamin E / regulation of ryanodine-sensitive calcium-release channel activity / toxic substance binding / RHO GTPases activate IQGAPs / voltage-gated calcium channel activity / smooth endoplasmic reticulum / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / calcium channel inhibitor activity / cellular response to interferon-beta / eNOS activation / Protein methylation / voltage-gated potassium channel complex / Activation of AMPK downstream of NMDARs / skeletal muscle fiber development / striated muscle contraction / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / T cell proliferation / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / : / Ion homeostasis / titin binding / positive regulation of protein autophosphorylation / regulation of calcium-mediated signaling / sperm midpiece / release of sequestered calcium ion into cytosol / muscle contraction / regulation of cytosolic calcium ion concentration / calcium channel complex / sarcoplasmic reticulum membrane / substantia nigra development / adenylate cyclase activator activity / Ras activation upon Ca2+ influx through NMDA receptor 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.8 Å | |||||||||||||||
 データ登録者 データ登録者 | Ma, R. / Haji-Ghassemi, O. / Ma, D. / Lin, L. / Samurkas, A. / Van Petegem, F. / Yuchi, Z. | |||||||||||||||
| 資金援助 |  中国, 中国,  カナダ, 4件 カナダ, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Nat Chem Biol / 年: 2020 ジャーナル: Nat Chem Biol / 年: 2020タイトル: Structural basis for diamide modulation of ryanodine receptor. 著者: Ruifang Ma / Omid Haji-Ghassemi / Dan Ma / Heng Jiang / Lianyun Lin / Li Yao / Arthur Samurkas / Yuxin Li / Yiwen Wang / Peng Cao / Shian Wu / Yan Zhang / Takashi Murayama / Bernard Moussian ...著者: Ruifang Ma / Omid Haji-Ghassemi / Dan Ma / Heng Jiang / Lianyun Lin / Li Yao / Arthur Samurkas / Yuxin Li / Yiwen Wang / Peng Cao / Shian Wu / Yan Zhang / Takashi Murayama / Bernard Moussian / Filip Van Petegem / Zhiguang Yuchi /      要旨: The diamide insecticide class is one of the top-selling insecticides globally. They are used to control a wide range of pests by targeting their ryanodine receptors (RyRs). Here, we report the ...The diamide insecticide class is one of the top-selling insecticides globally. They are used to control a wide range of pests by targeting their ryanodine receptors (RyRs). Here, we report the highest-resolution cryo-electron microscopy (cryo-EM) structure of RyR1 in the open state, in complex with the anthranilic diamide chlorantraniliprole (CHL). The 3.2-Å local resolution map facilitates unambiguous assignment of the CHL binding site. The molecule induces a conformational change by affecting the S4-S5 linker, triggering channel opening. The binding site is further corroborated by mutagenesis data, which reveal how diamide insecticides are selective to the Lepidoptera group of insects over honeybee or mammalian RyRs. Our data reveal that several pests have developed resistance via two mechanisms, steric hindrance and loss of contact. Our results provide a foundation for the development of highly selective pesticides aimed at overcoming resistance and therapeutic molecules to treat human myopathies. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6m2w.cif.gz 6m2w.cif.gz | 2.7 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6m2w.ent.gz pdb6m2w.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  6m2w.json.gz 6m2w.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  6m2w_validation.pdf.gz 6m2w_validation.pdf.gz | 1.8 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  6m2w_full_validation.pdf.gz 6m2w_full_validation.pdf.gz | 2 MB | 表示 | |
| XML形式データ |  6m2w_validation.xml.gz 6m2w_validation.xml.gz | 377 KB | 表示 | |
| CIF形式データ |  6m2w_validation.cif.gz 6m2w_validation.cif.gz | 598.8 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/m2/6m2w https://data.pdbj.org/pub/pdb/validation_reports/m2/6m2w ftp://data.pdbj.org/pub/pdb/validation_reports/m2/6m2w ftp://data.pdbj.org/pub/pdb/validation_reports/m2/6m2w | HTTPS FTP |
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 3種, 12分子 ADGJBEHKCFIL
| #1: タンパク質 | 分子量: 539851.000 Da / 分子数: 4 / 由来タイプ: 天然 / 由来: (天然)  #2: タンパク質 | 分子量: 11667.305 Da / 分子数: 4 / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: FKBP1B, FKBP12.6, FKBP1L, FKBP9, OTK4 / 発現宿主:  #3: タンパク質 | 分子量: 16620.402 Da / 分子数: 4 / Mutation: E32A, E68A, E105A, E141A / 由来タイプ: 組換発現 / 由来: (組換発現)  Homo sapiens (ヒト) / 遺伝子: CALM1, CALM, CAM, CAM1 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CALM1, CALM, CAM, CAM1 / 発現宿主:  |
|---|
-非ポリマー , 5種, 20分子 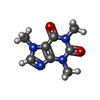



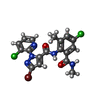




| #4: 化合物 | ChemComp-CFF / #5: 化合物 | ChemComp-CA / #6: 化合物 | ChemComp-ATP / #7: 化合物 | ChemComp-ZN / #8: 化合物 | ChemComp-F0U / |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|---|
| 配列の詳細 | Complete sequence of RyR1 protein is: ...Complete sequence of RyR1 protein is: MGDGGEGEDE |
 ムービー
ムービー コントローラー
コントローラー



 UCSF Chimera
UCSF Chimera












 PDBj
PDBj
























