+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6123 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Helical nanotube formed from a 29-residue peptide | |||||||||
 マップデータ マップデータ | reconstruction of Form I polymer | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | IHRSR / polymorphism / coiled-coils | |||||||||
| 生物種 | synthetic construct (人工物) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Egelman EH / Xu C / DiMaio F / Magnotti E / Modlin C / Yu X / Wright E / Baker D / Conticello VP | |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2015 ジャーナル: Structure / 年: 2015タイトル: Structural plasticity of helical nanotubes based on coiled-coil assemblies. 著者: E H Egelman / C Xu / F DiMaio / E Magnotti / C Modlin / X Yu / E Wright / D Baker / V P Conticello /  要旨: Numerous instances can be seen in evolution in which protein quaternary structures have diverged while the sequences of the building blocks have remained fairly conserved. However, the path through ...Numerous instances can be seen in evolution in which protein quaternary structures have diverged while the sequences of the building blocks have remained fairly conserved. However, the path through which such divergence has taken place is usually not known. We have designed two synthetic 29-residue α-helical peptides, based on the coiled-coil structural motif, that spontaneously self-assemble into helical nanotubes in vitro. Using electron cryomicroscopy with a newly available direct electron detection capability, we can achieve near-atomic resolution of these thin structures. We show how conservative changes of only one or two amino acids result in dramatic changes in quaternary structure, in which the assemblies can be switched between two very different forms. This system provides a framework for understanding how small sequence changes in evolution can translate into very large changes in supramolecular structure, a phenomenon that may have significant implications for the de novo design of synthetic peptide assemblies. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6123.map.gz emd_6123.map.gz | 345.2 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6123-v30.xml emd-6123-v30.xml emd-6123.xml emd-6123.xml | 8.4 KB 8.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  400_6123.gif 400_6123.gif 80_6123.gif 80_6123.gif | 51.2 KB 4.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6123 http://ftp.pdbj.org/pub/emdb/structures/EMD-6123 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6123 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6123 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6123_validation.pdf.gz emd_6123_validation.pdf.gz | 315.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6123_full_validation.pdf.gz emd_6123_full_validation.pdf.gz | 315.3 KB | 表示 | |
| XML形式データ |  emd_6123_validation.xml.gz emd_6123_validation.xml.gz | 5.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6123 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6123 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6123 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6123 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6123.map.gz / 形式: CCP4 / 大きさ: 3.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6123.map.gz / 形式: CCP4 / 大きさ: 3.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | reconstruction of Form I polymer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.02 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
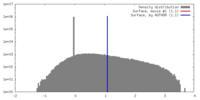
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : synthetic peptide
| 全体 | 名称: synthetic peptide (人工物) |
|---|---|
| 要素 |
|
-超分子 #1000: synthetic peptide
| 超分子 | 名称: synthetic peptide / タイプ: sample / ID: 1000 / 集合状態: polymer / Number unique components: 1 |
|---|
-分子 #1: synthetic peptide
| 分子 | 名称: synthetic peptide / タイプ: protein_or_peptide / ID: 1 / 詳細: QARILEADAEILRAYARILEAHAEILRAQ / 組換発現: No / データベース: NCBI |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / 装置: FEI VITROBOT MARK IV |
|---|
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 日付 | 2013年8月1日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 実像数: 260 / 平均電子線量: 10 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 4.4 µm / 最小 デフォーカス(公称値): 1.4 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | IHRSR |
|---|---|
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 2.2 Å 想定した対称性 - らせんパラメータ - ΔΦ: 87.1 ° 想定した対称性 - らせんパラメータ - 軸対称性: C1 (非対称) アルゴリズム: OTHER / 解像度のタイプ: BY AUTHOR / 解像度: 3.6 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: Spider |
| CTF補正 | 詳細: micrographs multiplied by CTF |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)