| 登録情報 | データベース: PDB / ID: 5sas
|
|---|
| タイトル | Endothiapepsin in complex with compound FU290-2 |
|---|
 要素 要素 | Endothiapepsin |
|---|
 キーワード キーワード | HYDROLASE/HYDROLASE inhibitor / Frag4Lead / fragment screening / hydrolase / inhibition / HYDROLASE-HYDROLASE inhibitor complex |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
endothiapepsin / aspartic-type endopeptidase activity / proteolysis類似検索 - 分子機能 Aspergillopepsin-like catalytic domain / Eukaryotic aspartyl protease / Aspartic peptidase A1 family / Peptidase family A1 domain / Peptidase family A1 domain profile. / Aspartic peptidase, active site / Eukaryotic and viral aspartyl proteases active site. / Aspartic peptidase domain superfamily類似検索 - ドメイン・相同性 BROMIDE ION / (1R)-1-(4-chlorophenyl)ethyl carbamimidothioate / Endothiapepsin類似検索 - 構成要素 |
|---|
| 生物種 |  Cryphonectria parasitica (菌類) Cryphonectria parasitica (菌類) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 1.17 Å フーリエ合成 / 解像度: 1.17 Å |
|---|
 データ登録者 データ登録者 | Wollenhaupt, J. / Metz, A. / Messini, N. / Barthel, T. / Klebe, G. / Weiss, M.S. |
|---|
| 資金援助 |  ドイツ, 1件 ドイツ, 1件 | 組織 | 認可番号 | 国 |
|---|
| BMBF | Frag2Xtal 05K13RM1 and Frag4Lead 05K16RM1 |  ドイツ ドイツ |
|
|---|
 引用 引用 |  ジャーナル: Acta Crystallogr D Struct Biol / 年: 2021 ジャーナル: Acta Crystallogr D Struct Biol / 年: 2021
タイトル: Frag4Lead: growing crystallographic fragment hits by catalog using fragment-guided template docking.
著者: Metz, A. / Wollenhaupt, J. / Glockner, S. / Messini, N. / Huber, S. / Barthel, T. / Merabet, A. / Gerber, H.D. / Heine, A. / Klebe, G. / Weiss, M.S. |
|---|
| 履歴 | | 登録 | 2021年5月28日 | 登録サイト: RCSB / 処理サイト: RCSB |
|---|
| 改定 1.0 | 2021年9月1日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2021年9月29日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_PubMed / _citation.title / _citation_author.identifier_ORCID / _citation_author.name |
|---|
| 改定 1.2 | 2024年10月30日 | Group: Data collection / Structure summary
カテゴリ: chem_comp_atom / chem_comp_bond ...chem_comp_atom / chem_comp_bond / pdbx_entry_details / pdbx_modification_feature
Item: _pdbx_entry_details.has_protein_modification |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Cryphonectria parasitica (菌類)
Cryphonectria parasitica (菌類) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 1.17 Å
フーリエ合成 / 解像度: 1.17 Å  データ登録者
データ登録者 ドイツ, 1件
ドイツ, 1件  引用
引用 ジャーナル: Acta Crystallogr D Struct Biol / 年: 2021
ジャーナル: Acta Crystallogr D Struct Biol / 年: 2021 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 5sas.cif.gz
5sas.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb5sas.ent.gz
pdb5sas.ent.gz PDB形式
PDB形式 5sas.json.gz
5sas.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/sa/5sas
https://data.pdbj.org/pub/pdb/validation_reports/sa/5sas ftp://data.pdbj.org/pub/pdb/validation_reports/sa/5sas
ftp://data.pdbj.org/pub/pdb/validation_reports/sa/5sas リンク
リンク 集合体
集合体
 要素
要素 Cryphonectria parasitica (菌類) / 参照: UniProt: P11838, endothiapepsin
Cryphonectria parasitica (菌類) / 参照: UniProt: P11838, endothiapepsin

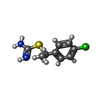






 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  BESSY
BESSY  / ビームライン: 14.1 / 波長: 0.9184 Å
/ ビームライン: 14.1 / 波長: 0.9184 Å 解析
解析 フーリエ合成 / 解像度: 1.17→42.72 Å / SU ML: 0.1518 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 19.0083
フーリエ合成 / 解像度: 1.17→42.72 Å / SU ML: 0.1518 / 交差検証法: FREE R-VALUE / σ(F): 1.35 / 位相誤差: 19.0083  ムービー
ムービー コントローラー
コントローラー

































 PDBj
PDBj






