登録情報 データベース : EMDB / ID : EMD-44354タイトル Synaptic Vesicle V-ATPase with synaptophysin and SidK, State 2 複合体 : Synaptic Vesicle V-ATPase with synaptophysin and SidK, State 2 / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
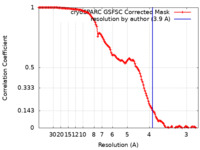
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Rattus norvegicus (ドブネズミ)手法 / / 解像度 : 3.9 Å Coupland CE / Rubinstein JL 資金援助 Organization Grant number 国 Canadian Institutes of Health Research (CIHR) PJT166152
ジャーナル : Science / 年 : 2024タイトル : High-resolution electron cryomicroscopy of V-ATPase in native synaptic vesicles.著者 : Claire E Coupland / Ryan Karimi / Stephanie A Bueler / Yingke Liang / Gautier M Courbon / Justin M Di Trani / Cassandra J Wong / Rayan Saghian / Ji-Young Youn / Lu-Yang Wang / John L Rubinstein / 要旨 : Intercellular communication in the nervous system occurs through the release of neurotransmitters into the synaptic cleft between neurons. In the presynaptic neuron, the proton pumping vesicular- or ... Intercellular communication in the nervous system occurs through the release of neurotransmitters into the synaptic cleft between neurons. In the presynaptic neuron, the proton pumping vesicular- or vacuolar-type ATPase (V-ATPase) powers neurotransmitter loading into synaptic vesicles (SVs), with the V complex dissociating from the membrane region of the enzyme before exocytosis. We isolated SVs from rat brain using SidK, a V-ATPase-binding bacterial effector protein. Single-particle electron cryomicroscopy allowed high-resolution structure determination of V-ATPase within the native SV membrane. In the structure, regularly spaced cholesterol molecules decorate the enzyme's rotor and the abundant SV protein synaptophysin binds the complex stoichiometrically. ATP hydrolysis during vesicle loading results in a loss of the V region of V-ATPase from the SV membrane, suggesting that loading is sufficient to induce dissociation of the enzyme. 履歴 登録 2024年3月31日 - ヘッダ(付随情報) 公開 2024年6月26日 - マップ公開 2024年6月26日 - 更新 2024年7月3日 - 現状 2024年7月3日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報
 データ登録者
データ登録者 カナダ, 1件
カナダ, 1件  引用
引用 ジャーナル: Science / 年: 2024
ジャーナル: Science / 年: 2024
 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_44354.map.gz
emd_44354.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-44354-v30.xml
emd-44354-v30.xml emd-44354.xml
emd-44354.xml EMDBヘッダ
EMDBヘッダ emd_44354_fsc.xml
emd_44354_fsc.xml FSCデータファイル
FSCデータファイル emd_44354.png
emd_44354.png emd-44354.cif.gz
emd-44354.cif.gz emd_44354_half_map_1.map.gz
emd_44354_half_map_1.map.gz emd_44354_half_map_2.map.gz
emd_44354_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-44354
http://ftp.pdbj.org/pub/emdb/structures/EMD-44354 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44354
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-44354 emd_44354_validation.pdf.gz
emd_44354_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_44354_full_validation.pdf.gz
emd_44354_full_validation.pdf.gz emd_44354_validation.xml.gz
emd_44354_validation.xml.gz emd_44354_validation.cif.gz
emd_44354_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44354
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44354 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44354
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-44354 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_44354.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_44354.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素
 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー

























 Z
Z Y
Y X
X