+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4157 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PilMNO complex from Thermus thermophilus | |||||||||
 マップデータ マップデータ | PilMNO complex from Thermus thermophilus | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |   Thermus thermophilus HB8 (バクテリア) Thermus thermophilus HB8 (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 23.0 Å | |||||||||
 データ登録者 データ登録者 | Derrick JP / Collins RF | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2013 ジャーナル: Proc Natl Acad Sci U S A / 年: 2013タイトル: Structure and assembly of an inner membrane platform for initiation of type IV pilus biogenesis. 著者: Vijaykumar Karuppiah / Richard F Collins / Angela Thistlethwaite / Ya Gao / Jeremy P Derrick /  要旨: Type IV pili are long fibers that are assembled by polymerization of a major pilin protein in the periplasm of a wide range of bacteria and archaea. They play crucial roles in pathogenesis, DNA ...Type IV pili are long fibers that are assembled by polymerization of a major pilin protein in the periplasm of a wide range of bacteria and archaea. They play crucial roles in pathogenesis, DNA transformation, and motility, and are capable of rapid retraction, generating powerful motor forces. PilN and PilO are integral inner membrane proteins that are essential for type IV pilus formation. Here, we show that PilN and PilO from Thermus thermophilus can be isolated as a complex with PilM, a cytoplasmic protein with structural similarities to the cytoskeletal protein MreB. The crystal structure of the periplasmic portion of PilN forms a homodimer with an extensive, conserved interaction interface. We conducted serial 3D reconstructions by electron microscopy of PilMN, PilMNO, and PilMNO bound to the major pilin protein PilA4, to chart the assembly of the inner membrane pilus biogenesis platform. PilN drives the dimerization of the PilMN complex with a stoichiometry of 2:2; binding of two PilO monomers then causes the PilN periplasmic domains to dissociate. Finally, two PilA4 monomers bind to the periplasmic domains of PilN and PilO, to generate a T-shaped complex that is primed for addition of the pilin to the nascent pilus fiber. Docking of structures for PilM, PilN, PilO, and PilA4 into the electron density maps of the transmembrane complexes was used to generate a sequence of molecular structures that chart the initial events in type IV pilus formation, and provide structural information on the early events in this important secretion process. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4157.map.gz emd_4157.map.gz | 396.9 KB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4157-v30.xml emd-4157-v30.xml emd-4157.xml emd-4157.xml | 9.5 KB 9.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_4157.png emd_4157.png | 67 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4157 http://ftp.pdbj.org/pub/emdb/structures/EMD-4157 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4157 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4157 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_4157_validation.pdf.gz emd_4157_validation.pdf.gz | 197.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_4157_full_validation.pdf.gz emd_4157_full_validation.pdf.gz | 196.9 KB | 表示 | |
| XML形式データ |  emd_4157_validation.xml.gz emd_4157_validation.xml.gz | 4.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4157 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4157 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4157 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4157 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4157.map.gz / 形式: CCP4 / 大きさ: 1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4157.map.gz / 形式: CCP4 / 大きさ: 1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | PilMNO complex from Thermus thermophilus | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.5 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
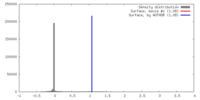
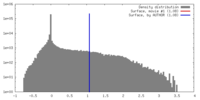
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : PilMNO complex
| 全体 | 名称: PilMNO complex |
|---|---|
| 要素 |
|
-超分子 #1: PilMNO complex
| 超分子 | 名称: PilMNO complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Thermus thermophilus HB8 (バクテリア) Thermus thermophilus HB8 (バクテリア) |
| 組換発現 | 生物種:  |
-分子 #1: PilN
| 分子 | 名称: PilN / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 配列 | 文字列: MIRLNLLPKN LRRRVEPGWW RLLALLFALV VLGVLGLVHY TAYTELSLAK AERDQLQAEV EALRPFIAE LGRLQEERKA LEALLAIREG LEKNAVPWSQ YLAAFINQIP RAGGRLEVAL R SVSARALS EEEAARLAQE GTYDGKRIRV EFALQGEALS REALVRFIRA ...文字列: MIRLNLLPKN LRRRVEPGWW RLLALLFALV VLGVLGLVHY TAYTELSLAK AERDQLQAEV EALRPFIAE LGRLQEERKA LEALLAIREG LEKNAVPWSQ YLAAFINQIP RAGGRLEVAL R SVSARALS EEEAARLAQE GTYDGKRIRV EFALQGEALS REALVRFIRA FETSPRFGIE FQ GASLDEG RGLYTFSARV GVTGGESGAR |
-分子 #2: PilM
| 分子 | 名称: PilM / タイプ: protein_or_peptide / ID: 2 / 光学異性体: LEVO |
|---|---|
| 配列 | 文字列: MFKSLSQLFR PRVEALGLEI GASALKLVEV SGNPPALKAL ASRPTPPGLL MEGMVAEPAA LAQEIKELL LEARTRKRYV VTALSNLAVI LRPIQVPKMP LKEMEEAVRW EAERYIPFPI D EVVLDFAP LTPLSEVQEG EQVQVMVAAA RQEAVAGVLE ALRGAGLVPV ...文字列: MFKSLSQLFR PRVEALGLEI GASALKLVEV SGNPPALKAL ASRPTPPGLL MEGMVAEPAA LAQEIKELL LEARTRKRYV VTALSNLAVI LRPIQVPKMP LKEMEEAVRW EAERYIPFPI D EVVLDFAP LTPLSEVQEG EQVQVMVAAA RQEAVAGVLE ALRGAGLVPV VLDVKPFAGL YP LEARLAE EPDRVFLALD IGAESTSLVL LRGDKPLAVR VLTLSGKDFT EAIARSFNLD LLA AEEVKR TYGMATLPTE DEELLLDFDA ERERYSPGRI YDAIRPVLVE LTQELRRSLE FFRI QLEEA SPEVGYLLGG GSKLRGLASL LTDTLGVNFE PVNPWEAVAV DPKRFESEQL QEIGP EFAV ALGLALRGVE PLD |
-分子 #3: PilO
| 分子 | 名称: PilO / タイプ: protein_or_peptide / ID: 3 / 光学異性体: LEVO |
|---|---|
| 配列 | 文字列: MLARLGQREW ALLAMVLTAL LGLLWYYLLI VPTRQEIATV RQEIDRLTIE RNRGLQARRA LPELRATIA ALQAQRLAFL RALPREERLA EVLSEVLQDA EASGVVVRSF TRSRTSAPVP E VRAVNLAL ALEAPFPETY AYLRRLEDLS RFSTLSGLNL SVQSQEANPT ...文字列: MLARLGQREW ALLAMVLTAL LGLLWYYLLI VPTRQEIATV RQEIDRLTIE RNRGLQARRA LPELRATIA ALQAQRLAFL RALPREERLA EVLSEVLQDA EASGVVVRSF TRSRTSAPVP E VRAVNLAL ALEAPFPETY AYLRRLEDLS RFSTLSGLNL SVQSQEANPT LATSLTLTVY VL AQGVEAE TGGSTP |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) 平均電子線量: 25.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 23.0 Å / 解像度の算出法: FSC 0.5 CUT-OFF / 使用した粒子像数: 15486 |
|---|---|
| 初期 角度割当 | タイプ: PROJECTION MATCHING |
| 最終 角度割当 | タイプ: PROJECTION MATCHING |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)