[English] 日本語
 Yorodumi
Yorodumi- PDB-2at9: STRUCTURE OF BACTERIORHODOPSIN AT 3.0 ANGSTROM BY ELECTRON CRYSTA... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 2at9 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | STRUCTURE OF BACTERIORHODOPSIN AT 3.0 ANGSTROM BY ELECTRON CRYSTALLOGRAPHY | |||||||||
 Components Components | BACTERIORHODOPSIN | |||||||||
 Keywords Keywords | PHOTORECEPTOR / PROTON PUMP / MEMBRANE PROTEIN / RETINAL PROTEIN / TWO-DIMENSIONAL CRYSTAL | |||||||||
| Function / homology |  Function and homology information Function and homology informationlight-driven active monoatomic ion transmembrane transporter activity / monoatomic ion channel activity / photoreceptor activity / phototransduction / proton transmembrane transport / plasma membrane Similarity search - Function | |||||||||
| Biological species |  Halobacterium salinarum (Halophile) Halobacterium salinarum (Halophile) | |||||||||
| Method | ELECTRON CRYSTALLOGRAPHY / electron crystallography / cryo EM / Resolution: 3 Å | |||||||||
 Authors Authors | Mitsuoka, K. / Hirai, T. / Murata, K. / Miyazawa, A. / Kidera, A. / Kimura, Y. / Fujiyoshi, Y. | |||||||||
 Citation Citation |  Journal: J Mol Biol / Year: 1999 Journal: J Mol Biol / Year: 1999Title: The structure of bacteriorhodopsin at 3.0 A resolution based on electron crystallography: implication of the charge distribution. Authors: K Mitsuoka / T Hirai / K Murata / A Miyazawa / A Kidera / Y Kimura / Y Fujiyoshi /  Abstract: Electron crystallography has the potential to visualise the charge status of atoms. This is due to the significantly different scattering factors of neutral and ionised atoms for electrons in the low- ...Electron crystallography has the potential to visualise the charge status of atoms. This is due to the significantly different scattering factors of neutral and ionised atoms for electrons in the low-resolution range (typically less than 5 A). In previous work, we observed two different types of densities around acidic residues in the experimental (|Fo|) map of bacteriorhodopsin (bR), a light-driven proton pump. We suggested that these might reflect different states of the acidic residues; namely, the protonated (neutral) and the deprotonated (negatively charged) state. To evaluate the observed charge more quantitatively, we refined the atomic model for bR and eight surrounding lipids using our electron crystallographic data set between 8.0 and 3.0 A resolution, where the charge effect is small. The refined model yielded an R-factor of 23.7% and a free R-factor of 33.0%. To evaluate the effect of charges on the density map, we calculated a difference (|Fo|-|Fc|) map including data of a resolution lower than 8.0 A resolution, where the charge effect is significant. We found strong peaks in the difference map mainly in the backbone region of the transmembrane helices. We interpreted these peaks to come from the polarisation of the polar groups in the main chain of the alpha-helices and we examined this by assuming a partial charge of 0.5 for the peptide carbonyl groups. The resulting R and free R-factors dropped from 0.250 and 0.341 to 0.246 and 0.336, respectively. Furthermore, we also observed some strong peaks around some side-chains, which could be assigned to positively charged atoms. Thus, we could show that Asp36 and Asp102 are likely to interact with cations nearby. In addition, peaks found around the acidic residues Glu74, Glu194 and Glu212 have different features and might represent positive charges on polarised water molecules or hydroxonium ions. #1:  Journal: Science / Year: 1998 Journal: Science / Year: 1998Title: Proton Transfer Pathways in Bacteriorhodopsin at 2.3 Angstrom Resolution Authors: Luecke, H. / Richter, H.T. / Lanyi, J.K. #2:  Journal: Nature / Year: 1997 Journal: Nature / Year: 1997Title: Surface of Bacteriorhodopsin Revealed by High-Resolution Electron Crystallography Authors: Kimura, Y. / Vassylyev, D.G. / Miyazawa, A. / Kidera, A. / Matsushima, M. / Mitsuoka, K. / Murata, K. / Hirai, T. / Fujiyoshi, Y. #3:  Journal: J.Mol.Biol. / Year: 1996 Journal: J.Mol.Biol. / Year: 1996Title: Electron-Crystallographic Refinement of the Structure of Bacteriorhodopsin Authors: Grigorieff, N. / Ceska, T.A. / Downing, K.H. / Baldwin, J.M. / Henderson, R. #4:  Journal: J.Mol.Biol. / Year: 1990 Journal: J.Mol.Biol. / Year: 1990Title: Model for the Structure of Bacteriorhodopsin Based on High-Resolution Electron Cryo-Microscopy Authors: Henderson, R. / Baldwin, J.M. / Ceska, T.A. / Zemlin, F. / Beckmann, E. / Downing, K.H. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  2at9.cif.gz 2at9.cif.gz | 68.9 KB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb2at9.ent.gz pdb2at9.ent.gz | 51.5 KB | Display |  PDB format PDB format |
| PDBx/mmJSON format |  2at9.json.gz 2at9.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  2at9_validation.pdf.gz 2at9_validation.pdf.gz | 801 KB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  2at9_full_validation.pdf.gz 2at9_full_validation.pdf.gz | 861.2 KB | Display | |
| Data in XML |  2at9_validation.xml.gz 2at9_validation.xml.gz | 17.8 KB | Display | |
| Data in CIF |  2at9_validation.cif.gz 2at9_validation.cif.gz | 22.8 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/at/2at9 https://data.pdbj.org/pub/pdb/validation_reports/at/2at9 ftp://data.pdbj.org/pub/pdb/validation_reports/at/2at9 ftp://data.pdbj.org/pub/pdb/validation_reports/at/2at9 | HTTPS FTP |
-Related structure data
| Similar structure data |
|---|
- Links
Links
- Assembly
Assembly
| Deposited unit | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||
| Unit cell |
|
- Components
Components
| #1: Protein | Mass: 26797.381 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  Halobacterium salinarum (Halophile) / Strain: JW5 / References: UniProt: P02945 Halobacterium salinarum (Halophile) / Strain: JW5 / References: UniProt: P02945 | ||||
|---|---|---|---|---|---|
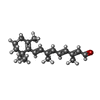
| #2: Chemical | ChemComp-RET / | ||||
| #3: Chemical | ChemComp-2DP / #4: Water | ChemComp-HOH / | Has protein modification | Y | |
-Experimental details
-Experiment
| Experiment | Method: ELECTRON CRYSTALLOGRAPHY |
|---|---|
| EM experiment | Aggregation state: 2D ARRAY / 3D reconstruction method: electron crystallography |
- Sample preparation
Sample preparation
| Component | Name: Bacteriorhodopsin / Type: COMPLEX |
|---|---|
| Specimen | Embedding applied: YES / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES |
| EM embedding | Details: 3% (w/v) trehalose / Material: trehalose |
| Crystal | Density Matthews: 4.2 Å3/Da / Density % sol: 71 % |
| Crystal grow | *PLUS Method: other / Details: Kimura, Y., (1997) Nature, 389, 206. |
-Data collection
| EM imaging |
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Image recording |
| |||||||||||||||||||||
| Image scans |
| |||||||||||||||||||||
| Reflection | Biso Wilson estimate: 28.8 Å2 | |||||||||||||||||||||
| Reflection | *PLUS Highest resolution: 3 Å / Num. obs: 6892 / % possible obs: 78.4 % / Num. measured all: 110812 / Rmerge(I) obs: 0.313 |
- Processing
Processing
| Software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EM software |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3D reconstruction | Resolution: 3 Å / Resolution method: DIFFRACTION PATTERN/LAYERLINES | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement | Resolution: 3→8 Å / Data cutoff high absF: 1000000 / Data cutoff low absF: 0.001 / Cross valid method: THROUGHOUT / σ(F): 1
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | Biso mean: 14.2 Å2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine analyze |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement step | Cycle: LAST / Resolution: 3→8 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS refinement shell | Resolution: 3→3.13 Å / Total num. of bins used: 8
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Xplor file |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Software | *PLUS Version: 3.851 / Classification: refinement | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refinement | *PLUS Rfactor Rfree: 0.33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solvent computation | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Displacement parameters | *PLUS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints | *PLUS
|
 Movie
Movie Controller
Controller










 PDBj
PDBj









 FIELD EMISSION GUN
FIELD EMISSION GUN