+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | HIV-1 Vif in complex with human APOBEC3H, CBF-beta, ELOB, ELOC, CUL5, and RBX2 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | virus-host protein complex / ANTIVIRAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RUNX3 regulates RUNX1-mediated transcription / RUNX1 regulates transcription of genes involved in BCR signaling / mRNA Editing: C to U Conversion / Formation of the Editosome / RUNX1 regulates transcription of genes involved in interleukin signaling / RUNX2 regulates bone development / core-binding factor complex / RUNX1 regulates expression of components of tight junctions / positive regulation of CD8-positive, alpha-beta T cell differentiation / RUNX2 regulates chondrocyte maturation ...RUNX3 regulates RUNX1-mediated transcription / RUNX1 regulates transcription of genes involved in BCR signaling / mRNA Editing: C to U Conversion / Formation of the Editosome / RUNX1 regulates transcription of genes involved in interleukin signaling / RUNX2 regulates bone development / core-binding factor complex / RUNX1 regulates expression of components of tight junctions / positive regulation of CD8-positive, alpha-beta T cell differentiation / RUNX2 regulates chondrocyte maturation / single-stranded DNA cytosine deaminase / negative regulation of CD4-positive, alpha-beta T cell differentiation / DNA cytosine deamination / negative regulation by host of viral genome replication / : / lymphocyte differentiation / cytidine to uridine editing / cytidine deaminase activity / ERBB2 signaling pathway / clearance of foreign intracellular DNA / RUNX1 and FOXP3 control the development of regulatory T lymphocytes (Tregs) / negative regulation of single stranded viral RNA replication via double stranded DNA intermediate / : / RUNX2 regulates genes involved in cell migration / RUNX2 regulates genes involved in differentiation of myeloid cells / Transcriptional regulation by RUNX2 / NEDD8 transferase activity / retrotransposon silencing / RUNX1 regulates transcription of genes involved in differentiation of keratinocytes / myeloid cell differentiation / target-directed miRNA degradation / RUNX3 Regulates Immune Response and Cell Migration / elongin complex / VCB complex / definitive hemopoiesis / protein neddylation / RUNX1 regulates transcription of genes involved in differentiation of myeloid cells / Regulation of RUNX1 Expression and Activity / NEDD8 ligase activity / Cul5-RING ubiquitin ligase complex / response to redox state / SCF ubiquitin ligase complex / Cul2-RING ubiquitin ligase complex / SCF-dependent proteasomal ubiquitin-dependent protein catabolic process / RUNX1 regulates transcription of genes involved in WNT signaling / RUNX1 regulates estrogen receptor mediated transcription / RUNX1 interacts with co-factors whose precise effect on RUNX1 targets is not known / RUNX2 regulates osteoblast differentiation / site of DNA damage / Pausing and recovery of Tat-mediated HIV elongation / Tat-mediated HIV elongation arrest and recovery / cullin family protein binding / RUNX3 regulates p14-ARF / HIV elongation arrest and recovery / Pausing and recovery of HIV elongation / Tat-mediated elongation of the HIV-1 transcript / Formation of HIV-1 elongation complex containing HIV-1 Tat / Formation of HIV elongation complex in the absence of HIV Tat / RNA Polymerase II Transcription Elongation / Formation of RNA Pol II elongation complex / cell maturation / viral life cycle / RNA Polymerase II Pre-transcription Events / intrinsic apoptotic signaling pathway / post-translational protein modification / transcription corepressor binding / virion component / transcription elongation by RNA polymerase II / TP53 Regulates Transcription of DNA Repair Genes / transcription initiation at RNA polymerase II promoter / Vif-mediated degradation of APOBEC3G / Regulation of RUNX3 expression and activity / P-body / RUNX1 regulates genes involved in megakaryocyte differentiation and platelet function / calcium channel activity / Oxygen-dependent proline hydroxylation of Hypoxia-inducible Factor Alpha / Inactivation of CSF3 (G-CSF) signaling / Evasion by RSV of host interferon responses / Downregulation of ERBB2 signaling / Regulation of expression of SLITs and ROBOs / G1/S transition of mitotic cell cycle / Transcriptional regulation of granulopoiesis / osteoblast differentiation / protein polyubiquitination / ubiquitin-protein transferase activity / Regulation of RUNX2 expression and activity / ubiquitin protein ligase activity / Antigen processing: Ubiquitination & Proteasome degradation / positive regulation of proteasomal ubiquitin-dependent protein catabolic process / protein-macromolecule adaptor activity / RUNX1 regulates transcription of genes involved in differentiation of HSCs / Neddylation / signaling receptor activity / ubiquitin-dependent protein catabolic process / protein-containing complex assembly / defense response to virus / Estrogen-dependent gene expression / sequence-specific DNA binding / host cell cytoplasm / transcription by RNA polymerase II 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) | |||||||||
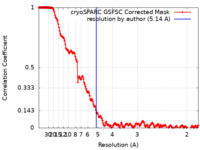
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 5.14 Å | |||||||||
 データ登録者 データ登録者 | Ito F / Alvarez-Cabrera AL / Zhou ZH / Chen XS | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2023 ジャーナル: Nat Commun / 年: 2023タイトル: Structural basis of HIV-1 Vif-mediated E3 ligase targeting of host APOBEC3H. 著者: Fumiaki Ito / Ana L Alvarez-Cabrera / Kyumin Kim / Z Hong Zhou / Xiaojiang S Chen /  要旨: Human APOBEC3 (A3) cytidine deaminases are antiviral factors that are particularly potent against retroviruses. As a countermeasure, HIV-1 uses a viral infectivity factor (Vif) to target specific ...Human APOBEC3 (A3) cytidine deaminases are antiviral factors that are particularly potent against retroviruses. As a countermeasure, HIV-1 uses a viral infectivity factor (Vif) to target specific human A3s for proteasomal degradation. Vif recruits cellular transcription cofactor CBF-β and Cullin-5 (CUL5) RING E3 ubiquitin ligase to bind different A3s distinctively, but how this is accomplished remains unclear in the absence of the atomic structure of the complex. Here, we present the cryo-EM structures of HIV-1 Vif in complex with human A3H, CBF-β and components of CUL5 ubiquitin ligase (CUL5, ELOB, and ELOC). Vif nucleates the entire complex by directly binding four human proteins, A3H, CBF-β, CUL5, and ELOC. The structures reveal a large interface area between A3H and Vif, primarily mediated by an α-helical side of A3H and a five-stranded β-sheet of Vif. This A3H-Vif interface unveils the basis for sensitivity-modulating polymorphism of both proteins, including a previously reported gain-of-function mutation in Vif isolated from HIV/AIDS patients. Our structural and functional results provide insights into the remarkable interplay between HIV and humans and would inform development efforts for anti-HIV therapeutics. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29490.map.gz emd_29490.map.gz | 483.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29490-v30.xml emd-29490-v30.xml emd-29490.xml emd-29490.xml | 21.7 KB 21.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29490_fsc.xml emd_29490_fsc.xml | 17 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29490.png emd_29490.png | 51.2 KB | ||
| Filedesc metadata |  emd-29490.cif.gz emd-29490.cif.gz | 6.2 KB | ||
| その他 |  emd_29490_half_map_1.map.gz emd_29490_half_map_1.map.gz emd_29490_half_map_2.map.gz emd_29490_half_map_2.map.gz | 475.8 MB 475.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29490 http://ftp.pdbj.org/pub/emdb/structures/EMD-29490 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29490 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29490 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29490_validation.pdf.gz emd_29490_validation.pdf.gz | 816.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29490_full_validation.pdf.gz emd_29490_full_validation.pdf.gz | 815.8 KB | 表示 | |
| XML形式データ |  emd_29490_validation.xml.gz emd_29490_validation.xml.gz | 26.4 KB | 表示 | |
| CIF形式データ |  emd_29490_validation.cif.gz emd_29490_validation.cif.gz | 34.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29490 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29490 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29490 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29490 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29490.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29490.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.92 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_29490_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
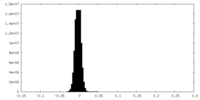
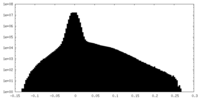
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_29490_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
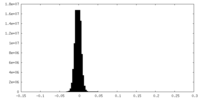
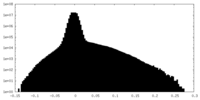
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Hetero-heptameric complex of HIV-1 Vif and human APOBEC3H, CBF-be...
| 全体 | 名称: Hetero-heptameric complex of HIV-1 Vif and human APOBEC3H, CBF-beta, ELOB, ELOC, CUL5, and RBX2 |
|---|---|
| 要素 |
|
-超分子 #1: Hetero-heptameric complex of HIV-1 Vif and human APOBEC3H, CBF-be...
| 超分子 | 名称: Hetero-heptameric complex of HIV-1 Vif and human APOBEC3H, CBF-beta, ELOB, ELOC, CUL5, and RBX2 タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Core-binding factor subunit beta
| 分子 | 名称: Core-binding factor subunit beta / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MPRVVPDQRS KFENEEFFR K LSRECEIK YT GFRDRPH EER QARFQN ACRD GRSEI AFVAT GTNL SLQFFP ASW QGEQRQT PS REYVDLER E AGKVYLKAP MILNGVCVIW KGWIDLQRL D GMGCLEFD EE RAQQEDA LAQ QAFEEA RRRT REFED RD UniProtKB: Core-binding factor subunit beta |
-分子 #2: Virion infectivity factor
| 分子 | 名称: Virion infectivity factor / タイプ: protein_or_peptide / ID: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Human immunodeficiency virus 1 (ヒト免疫不全ウイルス) Human immunodeficiency virus 1 (ヒト免疫不全ウイルス)株: pNL4-3 |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPMENRWQVM IV WQVDRMR INT WKRLVK HHMY ISRKA KDWFY RHHY ESTHPK ISS EVHIPLG DA KLVITTYW G LHTGERDWH LGQGVSIEWR KKRYSTQVD P DLADQLIH LH YFDCFSE SAI RNTILG RIVS PRCEY QAGHN KVGS LQYLAL AAL ...文字列: GPMENRWQVM IV WQVDRMR INT WKRLVK HHMY ISRKA KDWFY RHHY ESTHPK ISS EVHIPLG DA KLVITTYW G LHTGERDWH LGQGVSIEWR KKRYSTQVD P DLADQLIH LH YFDCFSE SAI RNTILG RIVS PRCEY QAGHN KVGS LQYLAL AAL IKPKQIK PP LPSVRKLT E DRWNK UniProtKB: Virion infectivity factor |
-分子 #3: Elongin-B
| 分子 | 名称: Elongin-B / タイプ: protein_or_peptide / ID: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDVFLMIRRH KTTIFTDAK E SSTVFELK RI VEGILKR PPD EQRLYK DDQL LDDGK TLGEC GFTS QTARPQ APA TVGLAFR AD DTFEALCI E PFSSPPELP DV UniProtKB: Elongin-B |
-分子 #4: Elongin-C
| 分子 | 名称: Elongin-C / タイプ: protein_or_peptide / ID: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MYVKLISSDG HEFIVKREH A LTSGTIKA ML SGPGQFA ENE TNEVNF REIP SHVLS KVCMY FTYK VRYTNS STE IPEFPIA PE IALELLMA A NFLDC UniProtKB: Elongin-C |
-分子 #5: Cullin-5
| 分子 | 名称: Cullin-5 / タイプ: protein_or_peptide / ID: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SLQFEDKWD FMRPIVLKLL RQESVTKQQ W FDLFSDVH AV CLWDDKG PAK IHQALK EDIL EFIKQ AQARV LSHQ DDTALL KAY IVEWRKF FT QCDILPKP F CQLEITLMG KQGSNKKSNV EDSIVRKLM L DTWNESIF SN IKNRLQD SAM KLVHAE ...文字列: SLQFEDKWD FMRPIVLKLL RQESVTKQQ W FDLFSDVH AV CLWDDKG PAK IHQALK EDIL EFIKQ AQARV LSHQ DDTALL KAY IVEWRKF FT QCDILPKP F CQLEITLMG KQGSNKKSNV EDSIVRKLM L DTWNESIF SN IKNRLQD SAM KLVHAE RLGE AFDSQ LVIGV RESY VNLCSN PED KLQIYRD NF EKAYLDST E RFYRTQAPS YLQQNGVQNY MKYADAKLK E EEKRALRY LE TRRECNS VEA LMECCV NALV TSFKE TILAE CQGM IKRNET EKL HLMFSLM DK VPNGIEPM L KDLEEHIIS AGLADMVAAA ETITTDSEK Y VEQLLTLF NR FSKLVKE AFQ DDPRFL TARD KAYKA VVNDA TIFK LELPLK QKG VGLKTQP ES KCPELLAN Y CDMLLRKTP LSKKLTSEEI EAKLKEVLL V LKYVQNKD VF MRYHKAH LTR RLILDI SADS EIEEN MVEWL REVG MPADYV NKL ARMFQDI KV SEDLNQAF K EMHKNNKLA LPADSVNIKI LNAGAWSRS S EKVFVSLP TE LEDLIPE VEE FYKKNH SGRK LHWHH LMSNG IITF KNEVGQ YDL EVTTFQL AV LFAWNQRP R EKISFENLK LATELPDAEL RRTLWSLVA F PKLKRQVL LY EPQVNSP KDF TEGTLF SVNQ EFSLI KNAKV QKRG KINLIG RLQ LTTERMR EE ENEGIVQL R ILRTQEAII QIMKMRKKIS NAQLQTELV E ILKNMFLP QK KMIKEQI EWL IEHKYI RRDE SDINT FIYMA UniProtKB: Cullin-5 |
-分子 #6: RING-box protein 2
| 分子 | 名称: RING-box protein 2 / タイプ: protein_or_peptide / ID: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MADVEDGEET CALASHSGS S GSKSGGDK MF SLKKWNA VAM WSWDVE CDTC AICRV QVMDA CLRC QAENKQ EDC VVVWGEC NH SFHNCCMS L WVKQNNRCP LCQQDWVVQR IGK UniProtKB: RING-box protein 2 |
-分子 #7: DNA dC->dU-editing enzyme APOBEC-3H
| 分子 | 名称: DNA dC->dU-editing enzyme APOBEC-3H / タイプ: protein_or_peptide / ID: 7 / 光学異性体: LEVO / EC番号: single-stranded DNA cytosine deaminase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPGGSGGMAL LTAETFR LQ FNNKRRLR R PYYPRKALL CYQLTPQNGS TPTRGYFEN K KKCHAEIC FI NEIKSMG LDE TQCYQV TCYL TWSPC SSCAW ELVD FIQAHD HLN LRIFASR LY YHWCKPQQ D GLRLLCGSQ VPVEVMGFPE FADCWENFV D ...文字列: GPGGSGGMAL LTAETFR LQ FNNKRRLR R PYYPRKALL CYQLTPQNGS TPTRGYFEN K KKCHAEIC FI NEIKSMG LDE TQCYQV TCYL TWSPC SSCAW ELVD FIQAHD HLN LRIFASR LY YHWCKPQQ D GLRLLCGSQ VPVEVMGFPE FADCWENFV D HEKPLSFN PY KMLEELD KNS RAIKRR LDRI KS UniProtKB: DNA dC->dU-editing enzyme APOBEC-3H |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.15 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 12546 / 平均露光時間: 8.0 sec. / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 150000 |
 ムービー
ムービー コントローラー
コントローラー


























 Z
Z Y
Y X
X