+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Helical reconstruction of the human cardiac actin-tropomyosin-myosin loop 4 7G mutant complex | |||||||||
 マップデータ マップデータ | Primary map used for model building. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | actin / tropomyosin / myosin / cardiac / MOTOR PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of heart rate by epinephrine / muscle thin filament tropomyosin / regulation of slow-twitch skeletal muscle fiber contraction / regulation of the force of skeletal muscle contraction / actin-myosin filament sliding / bleb / negative regulation of vascular associated smooth muscle cell migration / regulation of muscle contraction / muscle myosin complex / muscle filament sliding ...positive regulation of heart rate by epinephrine / muscle thin filament tropomyosin / regulation of slow-twitch skeletal muscle fiber contraction / regulation of the force of skeletal muscle contraction / actin-myosin filament sliding / bleb / negative regulation of vascular associated smooth muscle cell migration / regulation of muscle contraction / muscle myosin complex / muscle filament sliding / transition between fast and slow fiber / regulation of the force of heart contraction / myosin filament / ruffle organization / adult heart development / cardiac muscle hypertrophy in response to stress / positive regulation of ATP-dependent activity / Striated Muscle Contraction / myosin complex / ventricular cardiac muscle tissue morphogenesis / structural constituent of muscle / regulation of heart contraction / myosin II complex / microfilament motor activity / myosin binding / myofibril / sarcomere organization / heart contraction / mesenchyme migration / negative regulation of vascular associated smooth muscle cell proliferation / skeletal muscle contraction / positive regulation of cell adhesion / Smooth Muscle Contraction / striated muscle contraction / cardiac muscle contraction / stress fiber / ATP metabolic process / positive regulation of stress fiber assembly / cytoskeleton organization / cytoskeletal protein binding / regulation of heart rate / sarcomere / negative regulation of cell migration / filopodium / muscle contraction / actin filament / actin filament organization / wound healing / structural constituent of cytoskeleton / ruffle membrane / Z disc / cellular response to reactive oxygen species / actin filament binding / actin cytoskeleton / lamellipodium / actin binding / regulation of cell shape / cell body / cytoskeleton / calmodulin binding / protein heterodimerization activity / positive regulation of gene expression / protein homodimerization activity / ATP binding / identical protein binding / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
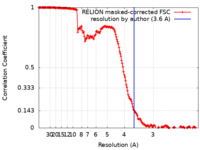
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Doran MH / Lehman W / Rynkiewicz MJ | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: J Gen Physiol / 年: 2023 ジャーナル: J Gen Physiol / 年: 2023タイトル: Myosin loop-4 is critical for optimal tropomyosin repositioning on actin during muscle activation and relaxation. 著者: Matthew H Doran / Michael J Rynkiewicz / Elumalai Pavadai / Skylar M L Bodt / David Rasicci / Jeffrey R Moore / Christopher M Yengo / Esther Bullitt / William Lehman /  要旨: During force-generating steps of the muscle crossbridge cycle, the tip of the myosin motor, specifically loop-4, contacts the tropomyosin cable of actin filaments. In the current study, we determined ...During force-generating steps of the muscle crossbridge cycle, the tip of the myosin motor, specifically loop-4, contacts the tropomyosin cable of actin filaments. In the current study, we determined the corresponding effect of myosin loop-4 on the regulatory positioning of tropomyosin on actin. To accomplish this, we compared high-resolution cryo-EM structures of myosin S1-decorated thin filaments containing either wild-type or a loop-4 mutant construct, where the seven-residue portion of myosin loop-4 that contacts tropomyosin was replaced by glycine residues, thus removing polar side chains from residues 366-372. Cryo-EM analysis of fully decorated actin-tropomyosin filaments with wild-type and mutant S1, yielded 3.4-3.6 Å resolution reconstructions, with even higher definition at the actin-myosin interface. Loop-4 densities both in wild-type and mutant S1 were clearly identified, and side chains were resolved in the wild-type structure. Aside from loop-4, actin and myosin structural domains were indistinguishable from each other when filaments were decorated with either mutant or wild-type S1. In marked contrast, the position of tropomyosin on actin in the two reconstructions differed by 3 to 4 Å. In maps of filaments containing the mutant, tropomyosin was located closer to the myosin-head and thus moved in the direction of the C-state conformation adopted by myosin-free thin filaments. Complementary interaction energy measurements showed that tropomyosin in the mutant thin filaments sits on actin in a local energy minimum, whereas tropomyosin is positioned by wild-type S1 in an energetically unfavorable location. We propose that the high potential energy associated with tropomyosin positioning in wild-type filaments favors an effective transition to B- and C-states following release of myosin from the thin filaments during relaxation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_28270.map.gz emd_28270.map.gz | 233.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-28270-v30.xml emd-28270-v30.xml emd-28270.xml emd-28270.xml | 25.4 KB 25.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_28270_fsc.xml emd_28270_fsc.xml | 17 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_28270.png emd_28270.png | 61.5 KB | ||
| マスクデータ |  emd_28270_msk_1.map emd_28270_msk_1.map | 421.9 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-28270.cif.gz emd-28270.cif.gz | 8.3 KB | ||
| その他 |  emd_28270_additional_1.map.gz emd_28270_additional_1.map.gz emd_28270_half_map_1.map.gz emd_28270_half_map_1.map.gz emd_28270_half_map_2.map.gz emd_28270_half_map_2.map.gz | 390.2 MB 337.2 MB 337.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-28270 http://ftp.pdbj.org/pub/emdb/structures/EMD-28270 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28270 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28270 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_28270_validation.pdf.gz emd_28270_validation.pdf.gz | 892.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_28270_full_validation.pdf.gz emd_28270_full_validation.pdf.gz | 891.9 KB | 表示 | |
| XML形式データ |  emd_28270_validation.xml.gz emd_28270_validation.xml.gz | 24.8 KB | 表示 | |
| CIF形式データ |  emd_28270_validation.cif.gz emd_28270_validation.cif.gz | 33 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28270 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28270 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28270 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-28270 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8encMC  8efiC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_28270.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_28270.map.gz / 形式: CCP4 / 大きさ: 421.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Primary map used for model building. | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.078 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_28270_msk_1.map emd_28270_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Uses the same data as the primary map,...
| ファイル | emd_28270_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Uses the same data as the primary map, but is globally filtered from the relion postprocessing job. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 1.
| ファイル | emd_28270_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2.
| ファイル | emd_28270_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2. | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human cardiac actin-tropomyosin-beta-myosin II complex with 7G lo...
| 全体 | 名称: Human cardiac actin-tropomyosin-beta-myosin II complex with 7G loop 4 mutation |
|---|---|
| 要素 |
|
-超分子 #1: Human cardiac actin-tropomyosin-beta-myosin II complex with 7G lo...
| 超分子 | 名称: Human cardiac actin-tropomyosin-beta-myosin II complex with 7G loop 4 mutation タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3 詳細: Cardiac actomyosin-tropomyosin complex with seven loop 4 residues mutated to glycine. |
|---|
-超分子 #2: Cardiac F-actin complex
| 超分子 | 名称: Cardiac F-actin complex / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #2 / 詳細: F-actin forms the backbone of the complex |
|---|---|
| 由来(天然) | 生物種:  |
-超分子 #3: Human beta-cardiac myosin II with seven (366-372) loop 4 residues...
| 超分子 | 名称: Human beta-cardiac myosin II with seven (366-372) loop 4 residues mutated to glycine. タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #1 詳細: The motor domain of the myosin saturates the actin filament. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #4: Human cardiac tropomyosin
| 超分子 | 名称: Human cardiac tropomyosin / タイプ: complex / ID: 4 / 親要素: 1 / 含まれる分子: #3 / 詳細: Tropomyosin wraps around the F-actin core. |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Myosin-7
| 分子 | 名称: Myosin-7 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 222.931328 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGDSEMAVFG AAAPYLRKSE KERLEAQTRP FDLKKDVFVP DDKQEFVKAK IVSREGGKVT AETEYGKTVT VKEDQVMQQN PPKFDKIED MAMLTFLHEP AVLYNLKDRY GSWMIYTYSG LFCVTVNPYK WLPVYTPEVV AAYRGKKRSE APPHIFSISD N AYQYMLTD ...文字列: MGDSEMAVFG AAAPYLRKSE KERLEAQTRP FDLKKDVFVP DDKQEFVKAK IVSREGGKVT AETEYGKTVT VKEDQVMQQN PPKFDKIED MAMLTFLHEP AVLYNLKDRY GSWMIYTYSG LFCVTVNPYK WLPVYTPEVV AAYRGKKRSE APPHIFSISD N AYQYMLTD RENQSILITG ESGAGKTVNT KRVIQYFAVI AAIGDRSKKD QSPGKGTLED QIIQANPALE AFGNAKTVRN DN SSRFGKF IRIHFGATGK LASADIETYL LEKSRVIFQL KAERDYHIFY QILSNKKPEL LDMLLITNNP YDYAFISQGE TTV ASIDDA EELMATDNAF DVLGFTSEEK NSMYKLTGAI MHFGNMKFKG GGGGGGAEPD GTEEADKSAY LMGLNSADLL KGLC HPRVK VGNEYVTKGQ NVQQVIYATG ALAKAVYERM FNWMVTRINA TLETKQPRQY FIGVLDIAGF EIFDFNSFEQ LCINF TNEK LQQFFNHHMF VLEQEEYKKE GIEWTFIDFG MDLQACIDLI EKPMGIMSIL EEECMFPKAT DMTFKAKLFD NHLGKS ANF QKPRNIKGKP EAHFSLIHYA GIVDYNIIGW LQKNKDPLNE TVVGLYQKSS LKLLSTLFAN YAGADAPIEK GKGKAKK GS SFQTVSALHR ENLNKLMTNL RSTHPHFVRC IIPNETKSPG VMDNPLVMHQ LRCNGVLEGI RICRKGFPNR ILYGDFRQ R YRILNPAAIP EGQFIDSRKG AEKLLSSLDI DHNQYKFGHT KVFFKAGLLG LLEEMRDERL SRIITRIQAQ SRGVLARME YKKLLERRDS LLVIQWNIRA FMGVKNWPWM KLYFKIKPLL KSAEREKEMA SMKEEFTRLK EALEKSEARR KELEEKMVSL LQEKNDLQL QVQAEQDNLA DAEERCDQLI KNKIQLEAKV KEMNERLEDE EEMNAELTAK KRKLEDECSE LKRDIDDLEL T LAKVEKEK HATENKVKNL TEEMAGLDEI IAKLTKEKKA LQEAHQQALD DLQAEEDKVN TLTKAKVKLE QQVDDLEGSL EQ EKKVRMD LERAKRKLEG DLKLTQESIM DLENDKQQLD ERLKKKDFEL NALNARIEDE QALGSQLQKK LKELQARIEE LEE ELEAER TARAKVEKLR SDLSRELEEI SERLEEAGGA TSVQIEMNKK REAEFQKMRR DLEEATLQHE ATAAALRKKH ADSV AELGE QIDNLQRVKQ KLEKEKSEFK LELDDVTSNM EQIIKAKANL EKMCRTLEDQ MNEHRSKAEE TQRSVNDLTS QRAKL QTEN GELSRQLDEK EALISQLTRG KLTYTQQLED LKRQLEEEVK AKNALAHALQ SARHDCDLLR EQYEEETEAK AELQRV LSK ANSEVAQWRT KYETDAIQRT EELEEAKKKL AQRLQEAEEA VEAVNAKCSS LEKTKHRLQN EIEDLMVDVE RSNAAAA AL DKKQRNFDKI LAEWKQKYEE SQSELESSQK EARSLSTELF KLKNAYEESL EHLETFKREN KNLQEEISDL TEQLGSSG K TIHELEKVRK QLEAEKMELQ SALEEAEASL EHEEGKILRA QLEFNQIKAE IERKLAEKDE EMEQAKRNHL RVVDSLQTS LDAETRSRNE ALRVKKKMEG DLNEMEIQLS HANRMAAEAQ KQVKSLQSLL KDTQIQLDDA VRANDDLKEN IAIVERRNNL LQAELEELR AVVEQTERSR KLAEQELIET SERVQLLHSQ NTSLINQKKK MDADLSQLQT EVEEAVQECR NAEEKAKKAI T DAAMMAEE LKKEQDTSAH LERMKKNMEQ TIKDLQHRLD EAEQIALKGG KKQLQKLEAR VRELENELEA EQKRNAESVK GM RKSERRI KELTYQTEED RKNLLRLQDL VDKLQLKVKA YKRQAEEAEE QANTNLSKFR KVQHELDEAE ERADIAESQV NKL RAKSRD IGTKGLNEE UniProtKB: Myosin-7 |
-分子 #2: Actin, alpha cardiac muscle 1
| 分子 | 名称: Actin, alpha cardiac muscle 1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 42.064891 KDa |
| 配列 | 文字列: MCDDEETTAL VCDNGSGLVK AGFAGDDAPR AVFPSIVGRP RHQGVMVGMG QKDSYVGDEA QSKRGILTLK YPIEHGIITN WDDMEKIWH HTFYNELRVA PEEHPTLLTE APLNPKANRE KMTQIMFETF NVPAMYVAIQ AVLSLYASGR TTGIVLDSGD G VTHNVPIY ...文字列: MCDDEETTAL VCDNGSGLVK AGFAGDDAPR AVFPSIVGRP RHQGVMVGMG QKDSYVGDEA QSKRGILTLK YPIEHGIITN WDDMEKIWH HTFYNELRVA PEEHPTLLTE APLNPKANRE KMTQIMFETF NVPAMYVAIQ AVLSLYASGR TTGIVLDSGD G VTHNVPIY EGYALPHAIM RLDLAGRDLT DYLMKILTER GYSFVTTAER EIVRDIKEKL CYVALDFENE MATAASSSSL EK SYELPDG QVITIGNERF RCPETLFQPS FIGMESAGIH ETTYNSIMKC DIDIRKDLYA NNVLSGGTTM YPGIADRMQK EIT ALAPST MKIKIIAPPE RKYSVWIGGS ILASLSTFQQ MWISKQEYDE AGPSIVHRKC F UniProtKB: Actin, alpha cardiac muscle 1 |
-分子 #3: Tropomyosin alpha-1 chain
| 分子 | 名称: Tropomyosin alpha-1 chain / タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 32.763621 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDAIKKKMQM LKLDKENALD RAEQAEADKK AAEDRSKQLE DELVSLQKKL KGTEDELDKY SEALKDAQEK LELAEKKATD AEADVASLN RRIQLVEEEL DRAQERLATA LQKLEEAEKA ADESERGMKV IESRAQKDEE KMEIQEIQLK EAKHIAEDAD R KYEEVARK ...文字列: MDAIKKKMQM LKLDKENALD RAEQAEADKK AAEDRSKQLE DELVSLQKKL KGTEDELDKY SEALKDAQEK LELAEKKATD AEADVASLN RRIQLVEEEL DRAQERLATA LQKLEEAEKA ADESERGMKV IESRAQKDEE KMEIQEIQLK EAKHIAEDAD R KYEEVARK LVIIESDLER AEERAELSEG KCAELEEELK TVTNNLKSLE AQAEKYSQKE DRYEEEIKVL SDKLKEAETR AE FAERSVT KLEKSIDDLE DELYAQKLKY KAISEELDHA LNDMTSI UniProtKB: Tropomyosin alpha-1 chain |
-分子 #4: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 4 / コピー数: 5 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #5: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 5 / コピー数: 5 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 濃度 | 0.13 mg/mL |
|---|---|
| 緩衝液 | pH: 7 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283 K / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 4 / 実像数: 4171 / 平均露光時間: 3.12 sec. / 平均電子線量: 54.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.0 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 80000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー

















 Z
Z Y
Y X
X