+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of Lates calcarifer Twinkle helicase, apo heptamer | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Lates calcarifer (あかめ) Lates calcarifer (あかめ) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 8.5 Å | |||||||||
 データ登録者 データ登録者 | Gao Y / Li Z | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2022 ジャーナル: Nucleic Acids Res / 年: 2022タイトル: Structural and dynamic basis of DNA capture and translocation by mitochondrial Twinkle helicase. 著者: Zhuo Li / Parminder Kaur / Chen-Yu Lo / Neil Chopra / Jamie Smith / Hong Wang / Yang Gao /  要旨: Twinkle is a mitochondrial replicative helicase which can self-load onto and unwind mitochondrial DNA. Nearly 60 mutations on Twinkle have been linked to human mitochondrial diseases. Using cryo- ...Twinkle is a mitochondrial replicative helicase which can self-load onto and unwind mitochondrial DNA. Nearly 60 mutations on Twinkle have been linked to human mitochondrial diseases. Using cryo-electron microscopy (cryo-EM) and high-speed atomic force microscopy (HS-AFM), we obtained the atomic-resolution structure of a vertebrate Twinkle homolog with DNA and captured in real-time how Twinkle is self-loaded onto DNA. Our data highlight the important role of the non-catalytic N-terminal domain of Twinkle. The N-terminal domain directly contacts the C-terminal helicase domain, and the contact interface is a hotspot for disease-related mutations. Mutations at the interface destabilize Twinkle hexamer and reduce helicase activity. With HS-AFM, we observed that a highly dynamic Twinkle domain, which is likely to be the N-terminal domain, can protrude ∼5 nm to transiently capture nearby DNA and initialize Twinkle loading onto DNA. Moreover, structural analysis and subunit doping experiments suggest that Twinkle hydrolyzes ATP stochastically, which is distinct from related helicases from bacteriophages. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27845.map.gz emd_27845.map.gz | 203.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27845-v30.xml emd-27845-v30.xml emd-27845.xml emd-27845.xml | 14.7 KB 14.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_27845.png emd_27845.png | 121 KB | ||
| その他 |  emd_27845_half_map_1.map.gz emd_27845_half_map_1.map.gz emd_27845_half_map_2.map.gz emd_27845_half_map_2.map.gz | 200.7 MB 200.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27845 http://ftp.pdbj.org/pub/emdb/structures/EMD-27845 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27845 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27845 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27845_validation.pdf.gz emd_27845_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27845_full_validation.pdf.gz emd_27845_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_27845_validation.xml.gz emd_27845_validation.xml.gz | 15.7 KB | 表示 | |
| CIF形式データ |  emd_27845_validation.cif.gz emd_27845_validation.cif.gz | 18.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27845 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27845 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27845 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27845 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27845.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27845.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.07 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
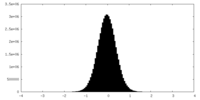
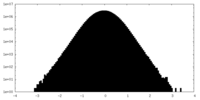
-ハーフマップ: #1
| ファイル | emd_27845_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
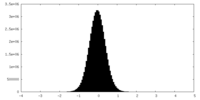
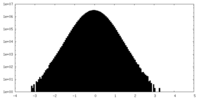
-ハーフマップ: #2
| ファイル | emd_27845_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Twinkle protein, mitochondrial
| 全体 | 名称: Twinkle protein, mitochondrial |
|---|---|
| 要素 |
|
-超分子 #1: Twinkle protein, mitochondrial
| 超分子 | 名称: Twinkle protein, mitochondrial / タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Lates calcarifer (あかめ) Lates calcarifer (あかめ) |
-分子 #1: Twinkle protein, mitochondrial
| 分子 | 名称: Twinkle protein, mitochondrial / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Lates calcarifer (あかめ) Lates calcarifer (あかめ) |
| 配列 | 文字列: MQKEEQDFLS PHVMLGYPES LDEQEEGERE LREVQRIWSS AVPFNDLPED EAQLIKTMFQ ITKVSNATLK KFGVRLFKP TKSLVFPWFA GPDSSLKGLK LLSAQNTDTE KVTYNEATVP KISSYYNLFG LTLVGRMDSE V VLTGHELD TLAVSQATGL PSVALPRGVS ...文字列: MQKEEQDFLS PHVMLGYPES LDEQEEGERE LREVQRIWSS AVPFNDLPED EAQLIKTMFQ ITKVSNATLK KFGVRLFKP TKSLVFPWFA GPDSSLKGLK LLSAQNTDTE KVTYNEATVP KISSYYNLFG LTLVGRMDSE V VLTGHELD TLAVSQATGL PSVALPRGVS CLPPMLLPYL EQFKRVTLWL GHDIRSWEAS KIFSRKLGLR RC SLVRPGE DRPCPLEALA RGKNLSRIIK TSIPAAHKSI VSFKQLREDV YGELLNTEQV AGVKWTRFPE LNR ILKGHR KGELTVFTGP TGSGKTTFIS EVALDLCIQG VNTLWGSFEI NNVRLAKIML TQFAMQRLEE NLEQ YDFWA DKFEELPLYF MTFHGQQNIK TVLDTMQHAV YLYDINHVII DNLQFMMGQE NLSIDKYAVQ DHIIG AFRK FATNTSCHVT LIIHPRKEED DRELQTASIF GSAKASQEAD NVLILQEKKL VTCPGRRSLQ VTKNRF DGD VGIFPLDFIK SSLTFSAPIK GKVKLRKVST KPENEEVGGE RGGSEEGRG |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 8 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 298 K / 装置: FEI VITROBOT MARK I |
| 詳細 | 50 mM Tris (pH 8.0), 150 mM KCl, 3 mM DTT, 1 mM ATP, and 2 mM MgCl2 |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 49.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3.0 µm / 最小 デフォーカス(公称値): 0.6 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 8.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC / 使用した粒子像数: 10252 |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
|---|
 ムービー
ムービー コントローラー
コントローラー








 Z
Z Y
Y X
X