[日本語] English
 万見
万見- EMDB-27802: Complex between MLL1-WRAD and an H2B-ubiquitinated nucleosome- State 1 -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Complex between MLL1-WRAD and an H2B-ubiquitinated nucleosome- State 1 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
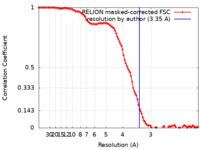
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.35 Å | |||||||||
 データ登録者 データ登録者 | Niklas HA / Rahman S / Worden EJ / Wolberger C | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: Multistate structures of the MLL1-WRAD complex bound to H2B-ubiquitinated nucleosome. 著者: Sanim Rahman / Niklas A Hoffmann / Evan J Worden / Marissa L Smith / Kevin E W Namitz / Bruce A Knutson / Michael S Cosgrove / Cynthia Wolberger /  要旨: The human Mixed Lineage Leukemia-1 (MLL1) complex methylates histone H3K4 to promote transcription and is stimulated by monoubiquitination of histone H2B. Recent structures of the MLL1-WRAD core ...The human Mixed Lineage Leukemia-1 (MLL1) complex methylates histone H3K4 to promote transcription and is stimulated by monoubiquitination of histone H2B. Recent structures of the MLL1-WRAD core complex, which comprises the MLL1 methyltransferase, DR5, bBp5, sh2L, and PY-30, have revealed variability in the docking of MLL1-WRAD on nucleosomes. In addition, portions of the Ash2L structure and the position of DPY30 remain ambiguous. We used an integrated approach combining cryoelectron microscopy (cryo-EM) and mass spectrometry cross-linking to determine a structure of the MLL1-WRAD complex bound to ubiquitinated nucleosomes. The resulting model contains the Ash2L intrinsically disordered region (IDR), SPRY insertion region, Sdc1-DPY30 interacting region (SDI-motif), and the DPY30 dimer. We also resolved three additional states of MLL1-WRAD lacking one or more subunits, which may reflect different steps in the assembly of MLL1-WRAD. The docking of subunits in all four states differs from structures of MLL1-WRAD bound to unmodified nucleosomes, suggesting that H2B-ubiquitin favors assembly of the active complex. Our results provide a more complete picture of MLL1-WRAD and the role of ubiquitin in promoting formation of the active methyltransferase complex. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27802.map.gz emd_27802.map.gz | 8.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27802-v30.xml emd-27802-v30.xml emd-27802.xml emd-27802.xml | 16.1 KB 16.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_27802_fsc.xml emd_27802_fsc.xml | 10.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_27802.png emd_27802.png | 56.5 KB | ||
| マスクデータ |  emd_27802_msk_1.map emd_27802_msk_1.map | 103 MB |  マスクマップ マスクマップ | |
| その他 |  emd_27802_additional_1.map.gz emd_27802_additional_1.map.gz emd_27802_half_map_1.map.gz emd_27802_half_map_1.map.gz emd_27802_half_map_2.map.gz emd_27802_half_map_2.map.gz | 80.7 MB 80.8 MB 80.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27802 http://ftp.pdbj.org/pub/emdb/structures/EMD-27802 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27802 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27802 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27802_validation.pdf.gz emd_27802_validation.pdf.gz | 701.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27802_full_validation.pdf.gz emd_27802_full_validation.pdf.gz | 700.8 KB | 表示 | |
| XML形式データ |  emd_27802_validation.xml.gz emd_27802_validation.xml.gz | 17.9 KB | 表示 | |
| CIF形式データ |  emd_27802_validation.cif.gz emd_27802_validation.cif.gz | 23.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27802 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27802 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27802 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27802 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27802.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27802.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.058 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_27802_msk_1.map emd_27802_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Unsharpened map
| ファイル | emd_27802_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_27802_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_27802_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : RBBP5 bound to an H2B-ubiquitinated nucleosome
| 全体 | 名称: RBBP5 bound to an H2B-ubiquitinated nucleosome |
|---|---|
| 要素 |
|
-超分子 #1: RBBP5 bound to an H2B-ubiquitinated nucleosome
| 超分子 | 名称: RBBP5 bound to an H2B-ubiquitinated nucleosome / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 |
|---|
-超分子 #2: nucleosome
| 超分子 | 名称: nucleosome / タイプ: complex / キメラ: Yes / ID: 2 / 親要素: 1 |
|---|---|
| 由来(天然) | 生物種: |
| 組換発現 | 生物種:  |
-超分子 #3: MLL1 WRAD complex
| 超分子 | 名称: MLL1 WRAD complex / タイプ: complex / キメラ: Yes / ID: 3 / 親要素: 1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 5091 / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 2.8000000000000003 µm 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)