+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-23784 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | LolCDE nucleotide-free | |||||||||
 マップデータ マップデータ | Cryo-EM map of LolCDE in the nucleotide-bound conformation | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | ATP binding cassette transporter / ABC transporter / inner membrane / transport protein / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報protein localization to outer membrane / lipoprotein localization to outer membrane / トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う / lipoprotein transport / transmembrane transporter activity / ATP hydrolysis activity / ATP binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.5 Å | |||||||||
 データ登録者 データ登録者 | Sharma S / Liao M | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: Mechanism of LolCDE as a molecular extruder of bacterial triacylated lipoproteins. 著者: Stuti Sharma / Ruoyu Zhou / Li Wan / Shan Feng / KangKang Song / Chen Xu / Yanyan Li / Maofu Liao /   要旨: Lipoproteins are important for bacterial growth and antibiotic resistance. These proteins use lipid acyl chains attached to the N-terminal cysteine residue to anchor on the outer surface of ...Lipoproteins are important for bacterial growth and antibiotic resistance. These proteins use lipid acyl chains attached to the N-terminal cysteine residue to anchor on the outer surface of cytoplasmic membrane. In Gram-negative bacteria, many lipoproteins are transported to the outer membrane (OM), a process dependent on the ATP-binding cassette (ABC) transporter LolCDE which extracts the OM-targeted lipoproteins from the cytoplasmic membrane. Lipid-anchored proteins pose a unique challenge for transport machinery as they have both hydrophobic lipid moieties and soluble protein component, and the underlying mechanism is poorly understood. Here we determined the cryo-EM structures of nanodisc-embedded LolCDE in the nucleotide-free and nucleotide-bound states at 3.8-Å and 3.5-Å resolution, respectively. The structural analyses, together with biochemical and mutagenesis studies, uncover how LolCDE recognizes its substrate by interacting with the lipid and N-terminal peptide moieties of the lipoprotein, and identify the amide-linked acyl chain as the key element for LolCDE interaction. Upon nucleotide binding, the transmembrane helices and the periplasmic domains of LolCDE undergo large-scale, asymmetric movements, resulting in extrusion of the captured lipoprotein. Comparison of LolCDE and MacB reveals the conserved mechanism of type VII ABC transporters and emphasizes the unique properties of LolCDE as a molecule extruder of triacylated lipoproteins. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_23784.map.gz emd_23784.map.gz | 25.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-23784-v30.xml emd-23784-v30.xml emd-23784.xml emd-23784.xml | 12.5 KB 12.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_23784.png emd_23784.png | 43.7 KB | ||
| Filedesc metadata |  emd-23784.cif.gz emd-23784.cif.gz | 5.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-23784 http://ftp.pdbj.org/pub/emdb/structures/EMD-23784 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23784 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23784 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_23784_validation.pdf.gz emd_23784_validation.pdf.gz | 562 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_23784_full_validation.pdf.gz emd_23784_full_validation.pdf.gz | 561.6 KB | 表示 | |
| XML形式データ |  emd_23784_validation.xml.gz emd_23784_validation.xml.gz | 5.6 KB | 表示 | |
| CIF形式データ |  emd_23784_validation.cif.gz emd_23784_validation.cif.gz | 6.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23784 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23784 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23784 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23784 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_23784.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_23784.map.gz / 形式: CCP4 / 大きさ: 27 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM map of LolCDE in the nucleotide-bound conformation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.087 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Complex of LolC, LolE and LolD in a 1:1:2 stoichiometry
| 全体 | 名称: Complex of LolC, LolE and LolD in a 1:1:2 stoichiometry |
|---|---|
| 要素 |
|
-超分子 #1: Complex of LolC, LolE and LolD in a 1:1:2 stoichiometry
| 超分子 | 名称: Complex of LolC, LolE and LolD in a 1:1:2 stoichiometry タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 130 kDa/nm |
-分子 #1: Lipoprotein transporter subunit LolE
| 分子 | 名称: Lipoprotein transporter subunit LolE / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 45.385977 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MAMPLSLLIG LRFSRGRRRG GMVSLISVIS TIGIALGVAV LIVGLSAMNG FERELNNRIL AVVPHGEIEA VDQPWTNWQE ALDHVQKVP GIAAAAPYIN FTGLVESGAN LRAIQVKGVN PQQEQRLSAL PSFVQGDAWR NFKAGEQQII IGKGVADALK V KQGDWVSI ...文字列: MAMPLSLLIG LRFSRGRRRG GMVSLISVIS TIGIALGVAV LIVGLSAMNG FERELNNRIL AVVPHGEIEA VDQPWTNWQE ALDHVQKVP GIAAAAPYIN FTGLVESGAN LRAIQVKGVN PQQEQRLSAL PSFVQGDAWR NFKAGEQQII IGKGVADALK V KQGDWVSI MIPNSNPEHK LMQPKRVRLH VAGILQLSGQ LDHSFAMIPL ADAQQYLDMG SSVSGIALKM TDVFNANKLV RD AGEVTNS YVYIKSWIGT YGYMYRDIQM IRAIMYLAMV LVIGVACFNI VSTLVMAVKD KSGDIAVLRT LGAKDGLIRA IFV WYGLLA GLFGSLCGVI IGVVVSLQLT PIIEWIEKLI GHQFLSSDIY FIDFLPSELH WLDVFYVLVT ALLLSLLASW YPAR RASNI DPARVLSGQ UniProtKB: Lipoprotein transporter subunit LolE |
-分子 #2: Lipo-releasing system transmembrane protein lolC
| 分子 | 名称: Lipo-releasing system transmembrane protein lolC / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・物質の膜輸送を触媒する |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 43.295516 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MYQPVALFIG LRYMRGRAAD RFGRFVSWLS TIGITLGVMA LVTVLSVMNG FERELQNNIL GLMPQAILSS EHGSLNPQQL PETAVKLDG VNRVAPITTG DVVLQSARSV AVGVMLGIDP AQKDPLTPYL VNVKQTDLEP GKYNVILGEQ LASQLGVNRG D QIRVMVPS ...文字列: MYQPVALFIG LRYMRGRAAD RFGRFVSWLS TIGITLGVMA LVTVLSVMNG FERELQNNIL GLMPQAILSS EHGSLNPQQL PETAVKLDG VNRVAPITTG DVVLQSARSV AVGVMLGIDP AQKDPLTPYL VNVKQTDLEP GKYNVILGEQ LASQLGVNRG D QIRVMVPS ASQFTPMGRI PSQRLFNVIG TFAANSEVDG YEMLVNIEDA SRLMRYPAGN ITGWRLWLDE PLKVDSLSQQ KL PEGSKWQ DWRDRKGELF QAVRMEKNMM GLLLSLIVAV AAFNIITSLG LMVMEKQGEV AILQTQGLTP RQIMMVFMVQ GAS AGIIGA ILGAALGALL ASQLNNLMPI IGVLLDGAAL PVAIEPLQVI VIALVAMAIA LLSTLYPSWR AAATQPAEAL RYE UniProtKB: Transporter |
-分子 #3: Lipoprotein-releasing system ATP-binding protein LolD
| 分子 | 名称: Lipoprotein-releasing system ATP-binding protein LolD タイプ: protein_or_peptide / ID: 3 / コピー数: 2 / 光学異性体: LEVO EC番号: トランスロカーゼ; 他の化合物の輸送を触媒; ヌクレオシド三リン酸の加水分解に伴う |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 25.815721 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: KILLQCDNLC KRYQEGSVQT DVLHNVSFSV GEGEMMAIVG SSGSGKSTLL HLLGGLDTPT SGDVIFNGQP MSKLSSAAKA ELRNQKLGF IYQFHHLLPD FTALENVAMP LLIGKKKPAE INSRALEMLK AVGLDHRANH RPSELSGGER QRVAIARALV N NPRLVLAD ...文字列: KILLQCDNLC KRYQEGSVQT DVLHNVSFSV GEGEMMAIVG SSGSGKSTLL HLLGGLDTPT SGDVIFNGQP MSKLSSAAKA ELRNQKLGF IYQFHHLLPD FTALENVAMP LLIGKKKPAE INSRALEMLK AVGLDHRANH RPSELSGGER QRVAIARALV N NPRLVLAD EPTGNLDARN ADSIFQLLGE LNRLQGTAFL VVTHDLQLAK RMSRQLEMRD GRLTAELSMG RLTAELSM UniProtKB: Lipoprotein-releasing system ATP-binding protein LolD |
-分子 #4: ADP ORTHOVANADATE
| 分子 | 名称: ADP ORTHOVANADATE / タイプ: ligand / ID: 4 / コピー数: 2 / 式: AOV |
|---|---|
| 分子量 | 理論値: 544.156 Da |
| Chemical component information | 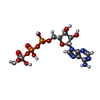 ChemComp-AOV: |
-分子 #5: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 5 / コピー数: 2 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: OTHER |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: OTHER |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 31971 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー

















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





















