+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human apo TRPM8 in a closed state (consensus map) | |||||||||
 マップデータ マップデータ | map sharpened locally with Local Filtering tool in cryoSPARC | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | calcium ion channel / cold temperature sensor / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ligand-gated calcium channel activity / thermoception / TRP channels / response to cold / calcium ion transmembrane transport / calcium channel activity / intracellular calcium ion homeostasis / positive regulation of cold-induced thermogenesis / membrane raft / external side of plasma membrane ...ligand-gated calcium channel activity / thermoception / TRP channels / response to cold / calcium ion transmembrane transport / calcium channel activity / intracellular calcium ion homeostasis / positive regulation of cold-induced thermogenesis / membrane raft / external side of plasma membrane / endoplasmic reticulum membrane / identical protein binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.65 Å | |||||||||
 データ登録者 データ登録者 | Palchevskyi S / Czarnocki-Cieciura M / Vistoli G / Gervasoni S / Nowak E / Beccari AR / Nowotny M / Talarico C | |||||||||
| 資金援助 |  ポーランド, 1件 ポーランド, 1件
| |||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2023 ジャーナル: Commun Biol / 年: 2023タイトル: Structure of human TRPM8 channel. 著者: Sergii Palchevskyi / Mariusz Czarnocki-Cieciura / Giulio Vistoli / Silvia Gervasoni / Elżbieta Nowak / Andrea R Beccari / Marcin Nowotny / Carmine Talarico /    要旨: TRPM8 is a non-selective cation channel permeable to both monovalent and divalent cations that is activated by multiple factors, such as temperature, voltage, pressure, and changes in osmolality. It ...TRPM8 is a non-selective cation channel permeable to both monovalent and divalent cations that is activated by multiple factors, such as temperature, voltage, pressure, and changes in osmolality. It is a therapeutic target for anticancer drug development, and its modulators can be utilized for several pathological conditions. Here, we present a cryo-electron microscopy structure of a human TRPM8 channel in the closed state that was solved at 2.7 Å resolution. Our structure comprises the most complete model of the N-terminal pre-melastatin homology region. We also visualized several lipids that are bound by the protein and modeled how the human channel interacts with icilin. Analyses of pore helices in available TRPM structures showed that all these structures can be grouped into different closed, desensitized and open state conformations based on the register of the pore helix S6 which positions particular amino acid residues at the channel constriction. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15982.map.gz emd_15982.map.gz | 13.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15982-v30.xml emd-15982-v30.xml emd-15982.xml emd-15982.xml | 19.9 KB 19.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15982_fsc.xml emd_15982_fsc.xml | 13.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15982.png emd_15982.png | 144.9 KB | ||
| マスクデータ |  emd_15982_msk_1.map emd_15982_msk_1.map | 282.6 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-15982.cif.gz emd-15982.cif.gz | 6.1 KB | ||
| その他 |  emd_15982_additional_1.map.gz emd_15982_additional_1.map.gz emd_15982_half_map_1.map.gz emd_15982_half_map_1.map.gz emd_15982_half_map_2.map.gz emd_15982_half_map_2.map.gz | 141.1 MB 261.8 MB 261.8 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15982 http://ftp.pdbj.org/pub/emdb/structures/EMD-15982 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15982 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15982 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15982_validation.pdf.gz emd_15982_validation.pdf.gz | 870.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15982_full_validation.pdf.gz emd_15982_full_validation.pdf.gz | 870.3 KB | 表示 | |
| XML形式データ |  emd_15982_validation.xml.gz emd_15982_validation.xml.gz | 22.8 KB | 表示 | |
| CIF形式データ |  emd_15982_validation.cif.gz emd_15982_validation.cif.gz | 29.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15982 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15982 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15982 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15982 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8bdcC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15982.map.gz / 形式: CCP4 / 大きさ: 282.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15982.map.gz / 形式: CCP4 / 大きさ: 282.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | map sharpened locally with Local Filtering tool in cryoSPARC | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.82 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15982_msk_1.map emd_15982_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
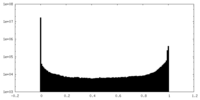
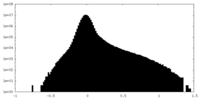
| 密度ヒストグラム |
-追加マップ: raw map
| ファイル | emd_15982_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | raw map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
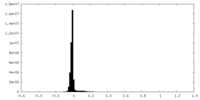
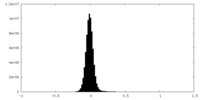
| 密度ヒストグラム |
-ハーフマップ: half map A
| ファイル | emd_15982_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
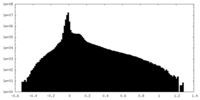
| 密度ヒストグラム |
-ハーフマップ: half map B
| ファイル | emd_15982_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
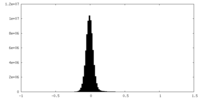
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human TRPM8 in apo form
| 全体 | 名称: Human TRPM8 in apo form |
|---|---|
| 要素 |
|
-超分子 #1: Human TRPM8 in apo form
| 超分子 | 名称: Human TRPM8 in apo form / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 510 KDa |
-分子 #1: TRPM8
| 分子 | 名称: TRPM8 / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  |
| 配列 | 文字列: SNSFRAARLS MRNRRNDTLD STRTLYSSAS RSTDLSYSES DLVNFIQANF KKRECVFFTK DSKATENVCK CGYAQSQHME GTQINQSEKW NYKKHTKEFP TDAFGDIQFE TLGKKGKYIR LSCDTDAEIL YELLTQHWHL KTPNLVISVT GGAKNFALKP RMRKIFSRLI ...文字列: SNSFRAARLS MRNRRNDTLD STRTLYSSAS RSTDLSYSES DLVNFIQANF KKRECVFFTK DSKATENVCK CGYAQSQHME GTQINQSEKW NYKKHTKEFP TDAFGDIQFE TLGKKGKYIR LSCDTDAEIL YELLTQHWHL KTPNLVISVT GGAKNFALKP RMRKIFSRLI YIAQSKGAWI LTGGTHYGLM KYIGEVVRDN TISRSSEENI VAIGIAAWGM VSNRDTLIRN CDAEGYFLAQ YLMDDFTRDP LYILDNNHTH LLLVDNGCHG HPTVEAKLRN QLEKYISERT IQDSNYGGKI PIVCFAQGGG KETLKAINTS IKNKIPCVVV EGSGQIADVI ASLVEVEDAL TSSAVKEKLV RFLPRTVSRL PEEETESWIK WLKEILECSH LLTVIKMEEA GDEIVSNAIS YALYKAFSTS EQDKDNWNGQ LKLLLEWNQL DLANDEIFTN DRRWESADLQ EVMFTALIKD RPKFVRLFLE NGLNLRKFLT HDVLTELFSN HFSTLVYRNL QIAKNSYNDA LLTFVWKLVA NFRRGFRKED RNGRDEMDIE LHDVSPITRH PLQALFIWAI LQNKKELSKV IWEQTRGCTL AALGASKLLK TLAKVKNDIN AAGESEELAN EYETRAVELF TECYSSDEDL AEQLLVYSCE AWGGSNCLEL AVEATDQHFI AQPGVQNFLS KQWYGEISRD TKNWKIILCL FIIPLVGCGF VSFRKKPVDK HKKLLWYYVA FFTSPFVVFS WNVVFYIAFL LLFAYVLLMD FHSVPHPPEL VLYSLVFVLF CDEVRQWYVN GVNYFTDLWN VMDTLGLFYF IAGIVFRLHS SNKSSLYSGR VIFCLDYIIF TLRLIHIFTV SRNLGPKIIM LQRMLIDVFF FLFLFAVWMV AFGVARQGIL RQNEQRWRWI FRSVIYEPYL AMFGQVPSDV DGTTYDFAHC TFTGNESKPL CVELDEHNLP RFPEWITIPL VCIYMLSTNI LLVNLLVAMF GYTVGTVQEN NDQVWKFQRY FLVQEYCSRL NIPFPFIVFA YFYMVVKKCF KCCCKEKNME SSVCCFKNED NETLAWEGVM KENYLVKINT KANDTSEEMR HRFRQLDTKL NDLKGLLKEI ANKIK UniProtKB: Transient receptor potential cation channel subfamily M member 8 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 |
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE 詳細: The grid was glow-discharged from both sides prior to vitrification |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | protein solubilized by LMNG |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 7918 / 平均電子線量: 41.42 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.7 µm / 最小 デフォーカス(公称値): 0.9 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






 Z
Z Y
Y X
X