+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Abortive infection DNA polymerase AbiK from Lactococcus lactis, Y44F variant | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 | Reverse transcriptase (RNA-dependent DNA polymerase) / Reverse transcriptase domain / Reverse transcriptase (RT) catalytic domain profile. / DNA/RNA polymerase superfamily / metal ion binding / AbiK 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Lactococcus lactis (乳酸菌) Lactococcus lactis (乳酸菌) | |||||||||
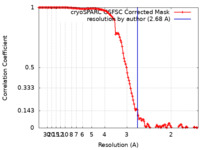
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.68 Å | |||||||||
 データ登録者 データ登録者 | Figiel M / Gapinska M / Czarnocki-Cieciura M / Zajko W / Nowotny M | |||||||||
| 資金援助 |  ポーランド, European Union, 2件 ポーランド, European Union, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2022 ジャーナル: Nucleic Acids Res / 年: 2022タイトル: Mechanism of protein-primed template-independent DNA synthesis by Abi polymerases. 著者: Małgorzata Figiel / Marta Gapińska / Mariusz Czarnocki-Cieciura / Weronika Zajko / Małgorzata Sroka / Krzysztof Skowronek / Marcin Nowotny 要旨: Abortive infection (Abi) is a bacterial antiphage defense strategy involving suicide of the infected cell. Some Abi pathways involve polymerases that are related to reverse transcriptases. They are ...Abortive infection (Abi) is a bacterial antiphage defense strategy involving suicide of the infected cell. Some Abi pathways involve polymerases that are related to reverse transcriptases. They are unique in the way they combine the ability to synthesize DNA in a template-independent manner with protein priming. Here, we report crystal and cryo-electron microscopy structures of two Abi polymerases: AbiK and Abi-P2. Both proteins adopt a bilobal structure with an RT-like domain that comprises palm and fingers subdomains and a unique helical domain. AbiK and Abi-P2 adopt a hexameric and trimeric configuration, respectively, which is unprecedented for reverse transcriptases. Biochemical experiments showed that the formation of these oligomers is required for the DNA polymerization activity. The structure of the AbiK-DNA covalent adduct visualized interactions between the 3' end of DNA and the active site and covalent attachment of the 5' end of DNA to a tyrosine residue used for protein priming. Our data reveal a structural basis of the mechanism of highly unusual template-independent protein-priming polymerases. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14435.map.gz emd_14435.map.gz | 8.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14435-v30.xml emd-14435-v30.xml emd-14435.xml emd-14435.xml | 17.5 KB 17.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14435_fsc.xml emd_14435_fsc.xml | 12.6 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14435.png emd_14435.png | 164.8 KB | ||
| マスクデータ |  emd_14435_msk_1.map emd_14435_msk_1.map | 216 MB |  マスクマップ マスクマップ | |
| その他 |  emd_14435_half_map_1.map.gz emd_14435_half_map_1.map.gz emd_14435_half_map_2.map.gz emd_14435_half_map_2.map.gz | 200.1 MB 200.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14435 http://ftp.pdbj.org/pub/emdb/structures/EMD-14435 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14435 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14435 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_14435_validation.pdf.gz emd_14435_validation.pdf.gz | 776.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_14435_full_validation.pdf.gz emd_14435_full_validation.pdf.gz | 776.1 KB | 表示 | |
| XML形式データ |  emd_14435_validation.xml.gz emd_14435_validation.xml.gz | 21.7 KB | 表示 | |
| CIF形式データ |  emd_14435_validation.cif.gz emd_14435_validation.cif.gz | 28.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14435 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14435 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14435 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14435 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14435.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14435.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.82 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_14435_msk_1.map emd_14435_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_14435_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_14435_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Homohexamer of L. lactis AbiK Y44F mutant
| 全体 | 名称: Homohexamer of L. lactis AbiK Y44F mutant |
|---|---|
| 要素 |
|
-超分子 #1: Homohexamer of L. lactis AbiK Y44F mutant
| 超分子 | 名称: Homohexamer of L. lactis AbiK Y44F mutant / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Lactococcus lactis (乳酸菌) Lactococcus lactis (乳酸菌) |
| 組換発現 | 生物種:  |
| 分子量 | 理論値: 420 KDa |
-分子 #1: AbiK
| 分子 | 名称: AbiK / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Lactococcus lactis (乳酸菌) Lactococcus lactis (乳酸菌) |
| 分子量 | 理論値: 71.617109 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSMKKEFTEL YDFIFDPIFL VRYGYYDRSI KNKKMNTAKV ELDNEFGKSD SFYFKVFNME SFADYLRSHD LKTHFNGKKP LSTDPVYFN IPKNIEARRQ YKMPNLYSYM ALNYYICDNK KEFIEVFIDN KFSTSKFFNQ LNFDYPKTQE ITQTLLYGGI K KLHLDLSN ...文字列: GSMKKEFTEL YDFIFDPIFL VRYGYYDRSI KNKKMNTAKV ELDNEFGKSD SFYFKVFNME SFADYLRSHD LKTHFNGKKP LSTDPVYFN IPKNIEARRQ YKMPNLYSYM ALNYYICDNK KEFIEVFIDN KFSTSKFFNQ LNFDYPKTQE ITQTLLYGGI K KLHLDLSN FYHTLYTHSI PWMIDGKSAS KQNRKKGFSN TLDTLITACQ YDETHGIPTG NLLSRIITEL YMCHFDKQME YK KFVYSRY VDDFIFPFTF ENEKQEFLNE FNLICRENNL IINDNKTKVD NFPFVDKSSK SDIFSFFENI TSTNSNDKWI KEI SNFIDY CVNEEHLGNK GAIKCIFPVI TNTLKQKKVD TKNIDNIFSK RNMVTNFNVF EKILDLSLKD SRLTNKFLTF FENI NEFGF SSLSASNIVK KYFSNNSKGL KEKIDHYRKN NFNQELYQIL LYMVVFEIDD LLNQEELLNL IDLNIDDYSL ILGTI LYLK NSSYKLEKLL KKIDQLFINT HANYDVKTSR MAEKLWLFRY FFYFLNCKNI FSQKEINSYC QSQNYNSGQN GYQTEL NWN YIKGQGKDLR ANNFFNELIV KEVWLISCGE NEDFKYLN |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.74 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7 構成要素:
| |||||||||||||||
| グリッド | モデル: C-flat-2/1 / 材質: COPPER / メッシュ: 200 / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー









 Z
Z Y
Y X
X