+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | human Lig1-DNA-PCNA complex reconstituted in absence of ATP | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | DNA / Replication / Complex / Ligase / PCNA / Ligation / Okazaki fragment maturation | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Okazaki fragment processing involved in mitotic DNA replication / Regulation of MITF-M-dependent genes involved in DNA damage repair and senescence / DNA ligase activity / DNA ligase (ATP) / positive regulation of deoxyribonuclease activity / dinucleotide insertion or deletion binding / PCNA-p21 complex / mitotic telomere maintenance via semi-conservative replication / DNA ligase (ATP) activity / purine-specific mismatch base pair DNA N-glycosylase activity ...Okazaki fragment processing involved in mitotic DNA replication / Regulation of MITF-M-dependent genes involved in DNA damage repair and senescence / DNA ligase activity / DNA ligase (ATP) / positive regulation of deoxyribonuclease activity / dinucleotide insertion or deletion binding / PCNA-p21 complex / mitotic telomere maintenance via semi-conservative replication / DNA ligase (ATP) activity / purine-specific mismatch base pair DNA N-glycosylase activity / MutLalpha complex binding / nuclear lamina / positive regulation of DNA-directed DNA polymerase activity / Polymerase switching / Telomere C-strand (Lagging Strand) Synthesis / Processive synthesis on the lagging strand / DNA ligation / PCNA complex / Removal of the Flap Intermediate / Processive synthesis on the C-strand of the telomere / Mismatch repair (MMR) directed by MSH2:MSH3 (MutSbeta) / Mismatch repair (MMR) directed by MSH2:MSH6 (MutSalpha) / Polymerase switching on the C-strand of the telomere / Transcription of E2F targets under negative control by DREAM complex / Removal of the Flap Intermediate from the C-strand / lagging strand elongation / replisome / response to L-glutamate / histone acetyltransferase binding / DNA biosynthetic process / DNA polymerase processivity factor activity / G1/S-Specific Transcription / leading strand elongation / replication fork processing / response to dexamethasone / Early Phase of HIV Life Cycle / nuclear replication fork / SUMOylation of DNA replication proteins / estrous cycle / POLB-Dependent Long Patch Base Excision Repair / PCNA-Dependent Long Patch Base Excision Repair / anatomical structure morphogenesis / mismatch repair / translesion synthesis / response to cadmium ion / DNA polymerase binding / cyclin-dependent protein kinase holoenzyme complex / epithelial cell differentiation / base-excision repair, gap-filling / positive regulation of DNA repair / Translesion synthesis by REV1 / Translesion synthesis by POLK / TP53 Regulates Transcription of Genes Involved in G2 Cell Cycle Arrest / Translesion synthesis by POLI / Gap-filling DNA repair synthesis and ligation in GG-NER / positive regulation of DNA replication / male germ cell nucleus / replication fork / liver regeneration / nuclear estrogen receptor binding / Recognition of DNA damage by PCNA-containing replication complex / Termination of translesion DNA synthesis / Translesion Synthesis by POLH / base-excision repair / HDR through Homologous Recombination (HRR) / Dual Incision in GG-NER / receptor tyrosine kinase binding / cellular response to hydrogen peroxide / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / cellular response to UV / cellular response to xenobiotic stimulus / response to estradiol / E3 ubiquitin ligases ubiquitinate target proteins / heart development / DNA recombination / damaged DNA binding / chromosome, telomeric region / nuclear body / cell division / intracellular membrane-bounded organelle / DNA repair / centrosome / chromatin binding / protein-containing complex binding / chromatin / enzyme binding / negative regulation of transcription by RNA polymerase II / mitochondrion / DNA binding / extracellular exosome / nucleoplasm / ATP binding / identical protein binding / nucleus / metal ion binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / synthetic construct (人工物) Homo sapiens (ヒト) / synthetic construct (人工物) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.58 Å | |||||||||
 データ登録者 データ登録者 | Blair K / Tehseen M / Raducanu VS / Shahid T / Lancey C / Cruehet R / Hamdan S / De Biasio A | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Mechanism of human Lig1 regulation by PCNA in Okazaki fragment sealing. 著者: Kerry Blair / Muhammad Tehseen / Vlad-Stefan Raducanu / Taha Shahid / Claudia Lancey / Fahad Rashid / Ramon Crehuet / Samir M Hamdan / Alfredo De Biasio /    要旨: During lagging strand synthesis, DNA Ligase 1 (Lig1) cooperates with the sliding clamp PCNA to seal the nicks between Okazaki fragments generated by Pol δ and Flap endonuclease 1 (FEN1). We present ...During lagging strand synthesis, DNA Ligase 1 (Lig1) cooperates with the sliding clamp PCNA to seal the nicks between Okazaki fragments generated by Pol δ and Flap endonuclease 1 (FEN1). We present several cryo-EM structures combined with functional assays, showing that human Lig1 recruits PCNA to nicked DNA using two PCNA-interacting motifs (PIPs) located at its disordered N-terminus (PIP) and DNA binding domain (PIP). Once Lig1 and PCNA assemble as two-stack rings encircling DNA, PIP is released from PCNA and only PIP is required for ligation to facilitate the substrate handoff from FEN1. Consistently, we observed that PCNA forms a defined complex with FEN1 and nicked DNA, and it recruits Lig1 to an unoccupied monomer creating a toolbelt that drives the transfer of DNA to Lig1. Collectively, our results provide a structural model on how PCNA regulates FEN1 and Lig1 during Okazaki fragments maturation. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
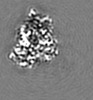
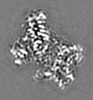
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14078.map.gz emd_14078.map.gz | 12.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14078-v30.xml emd-14078-v30.xml emd-14078.xml emd-14078.xml | 22.5 KB 22.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14078_fsc.xml emd_14078_fsc.xml | 9.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14078.png emd_14078.png | 68 KB | ||
| Filedesc metadata |  emd-14078.cif.gz emd-14078.cif.gz | 7.3 KB | ||
| その他 |  emd_14078_half_map_1.map.gz emd_14078_half_map_1.map.gz emd_14078_half_map_2.map.gz emd_14078_half_map_2.map.gz | 50.7 MB 50.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14078 http://ftp.pdbj.org/pub/emdb/structures/EMD-14078 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14078 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14078 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_14078_validation.pdf.gz emd_14078_validation.pdf.gz | 898.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_14078_full_validation.pdf.gz emd_14078_full_validation.pdf.gz | 897.8 KB | 表示 | |
| XML形式データ |  emd_14078_validation.xml.gz emd_14078_validation.xml.gz | 15.2 KB | 表示 | |
| CIF形式データ |  emd_14078_validation.cif.gz emd_14078_validation.cif.gz | 19.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14078 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14078 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14078 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14078 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7qnzMC  7qo1C  8b8tC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14078.map.gz / 形式: CCP4 / 大きさ: 12.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14078.map.gz / 形式: CCP4 / 大きさ: 12.9 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.835 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_14078_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_14078_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human Ligase holoenzyme without ATP present
| 全体 | 名称: Human Ligase holoenzyme without ATP present |
|---|---|
| 要素 |
|
-超分子 #1: Human Ligase holoenzyme without ATP present
| 超分子 | 名称: Human Ligase holoenzyme without ATP present / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#3, #5 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: DNA ligase 1
| 分子 | 名称: DNA ligase 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: DNA ligase (ATP) |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 101.877102 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MQRSIMSFFH PKKEGKAKKP EKEASNSSRE TEPPPKAALK EWNGVVSESD SPVKRPGRKA ARVLGSEGEE EDEALSPAKG QKPALDCSQ VSPPRPATSP ENNASLSDTS PMDSSPSGIP KRRTARKQLP KRTIQEVLEE QSEDEDREAK RKKEEEEEET P KESLTEAE ...文字列: MQRSIMSFFH PKKEGKAKKP EKEASNSSRE TEPPPKAALK EWNGVVSESD SPVKRPGRKA ARVLGSEGEE EDEALSPAKG QKPALDCSQ VSPPRPATSP ENNASLSDTS PMDSSPSGIP KRRTARKQLP KRTIQEVLEE QSEDEDREAK RKKEEEEEET P KESLTEAE VATEKEGEDG DQPTTPPKPL KTSKAETPTE SVSEPEVATK QELQEEEEQT KPPRRAPKTL SSFFTPRKPA VK KEVKEEE PGAPGKEGAA EGPLDPSGYN PAKNNYHPVE DACWKPGQKV PYLAVARTFE KIEEVSARLR MVETLSNLLR SVV ALSPPD LLPVLYLSLN HLGPPQQGLE LGVGDGVLLK AVAQATGRQL ESVRAEAAEK GDVGLVAENS RSTQRLMLPP PPLT ASGVF SKFRDIARLT GSASTAKKID IIKGLFVACR HSEARFIARS LSGRLRLGLA EQSVLAALSQ AVSLTPPGQE FPPAM VDAG KGKTAEARKT WLEEQGMILK QTFCEVPDLD RIIPVLLEHG LERLPEHCKL SPGIPLKPML AHPTRGISEV LKRFEE AAF TCEYKYDGQR AQIHALEGGE VKIFSRNQED NTGKYPDIIS RIPKIKLPSV TSFILDTEAV AWDREKKQIQ PFQVLTT RK RKEVDASEIQ VQVCLYAFDL IYLNGESLVR EPLSRRRQLL RENFVETEGE FVFATSLDTK DIEQIAEFLE QSVKDSCE G LMVKTLDVDA TYEIAKRSHN WLKLKKDYLD GVGDTLDLVV IGAYLGRGKR AGRYGGFLLA SYDEDSEELQ AICKLGTGF SDEELEEHHQ SLKALVLPSP RPYVRIDGAV IPDHWLDPSA VWEVKCADLS LSPIYPAARG LVDSDKGISL RFPRFIRVRE DKQPEQATT SAQVACLYRK QSQIQNQQGE DSGSDPEDTY UniProtKB: DNA ligase 1 |
-分子 #2: Proliferating cell nuclear antigen
| 分子 | 名称: Proliferating cell nuclear antigen / タイプ: protein_or_peptide / ID: 2 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 29.088061 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GPHMFEARLV QGSILKKVLE ALKDLINEAC WDISSSGVNL QSMDSSHVSL VQLTLRSEGF DTYRCDRNLA MGVNLTSMSK ILKCAGNED IITLRAEDNA DTLALVFEAP NQEKVSDYEM KLMDLDVEQL GIPEQEYSCV VKMPSGEFAR ICRDLSHIGD A VVISCAKD ...文字列: GPHMFEARLV QGSILKKVLE ALKDLINEAC WDISSSGVNL QSMDSSHVSL VQLTLRSEGF DTYRCDRNLA MGVNLTSMSK ILKCAGNED IITLRAEDNA DTLALVFEAP NQEKVSDYEM KLMDLDVEQL GIPEQEYSCV VKMPSGEFAR ICRDLSHIGD A VVISCAKD GVKFSASGEL GNGNIKLSQT SNVDKEEEAV TIEMNEPVQL TFALRYLNFF TKATPLSSTV TLSMSADVPL VV EYKIADM GHLKYYLAPK IEDEEGS UniProtKB: Proliferating cell nuclear antigen |
-分子 #3: Oligo19ddC
| 分子 | 名称: Oligo19ddC / タイプ: dna / ID: 3 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 5.802744 KDa |
| 配列 | 文字列: (DG)(DC)(DT)(DT)(DC)(DT)(DG)(DT)(DG)(DC) (DT)(DG)(DA)(DT)(DG)(DC)(DG)(DT)(DOC) |
-分子 #4: Oligo13P
| 分子 | 名称: Oligo13P / タイプ: dna / ID: 4 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 3.976599 KDa |
| 配列 | 文字列: (DG)(DT)(DC)(DG)(DG)(DA)(DC)(DT)(DG)(DA) (DA)(DC)(DC) |
-分子 #5: Oligo32
| 分子 | 名称: Oligo32 / タイプ: dna / ID: 5 / コピー数: 1 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 9.845345 KDa |
| 配列 | 文字列: (DG)(DG)(DT)(DT)(DC)(DA)(DG)(DT)(DC)(DC) (DG)(DA)(DC)(DG)(DA)(DC)(DG)(DC)(DA)(DT) (DC)(DA)(DG)(DC)(DA)(DC)(DA)(DG)(DA) (DA)(DG)(DC) |
-分子 #6: ADENOSINE MONOPHOSPHATE
| 分子 | 名称: ADENOSINE MONOPHOSPHATE / タイプ: ligand / ID: 6 / コピー数: 1 / 式: AMP |
|---|---|
| 分子量 | 理論値: 347.221 Da |
| Chemical component information |  ChemComp-AMP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: UltrAuFoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 300 sec. 詳細: The grid was coated with graphene oxide prior to use. | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 77.0 K / 最高: 77.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 1 / 実像数: 2966 / 平均露光時間: 2.0 sec. / 平均電子線量: 18.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-7qnz: |
 ムービー
ムービー コントローラー
コントローラー



























 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)