+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11113 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | stimulatory human GTP cyclohydrolase I - GFRP complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | GTP cyclohydrolase GFTP / I / EC:3.5.4.16 / Tetrahydrobiopterin (BH4) synthesis / Cytosol / Zinc Ion Binding / Hydrolase Activity / Metal Ion Binding / Nucleotide Binding / allosteric enzyme / substrate analogue bound / HYDROLASE | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報GTP cyclohydrolase binding / pteridine-containing compound biosynthetic process / dihydrobiopterin metabolic process / regulation of lung blood pressure / GTP cyclohydrolase I / GTP cyclohydrolase I activity / neuromuscular process controlling posture / negative regulation of biosynthetic process / GTP-dependent protein binding / regulation of removal of superoxide radicals ...GTP cyclohydrolase binding / pteridine-containing compound biosynthetic process / dihydrobiopterin metabolic process / regulation of lung blood pressure / GTP cyclohydrolase I / GTP cyclohydrolase I activity / neuromuscular process controlling posture / negative regulation of biosynthetic process / GTP-dependent protein binding / regulation of removal of superoxide radicals / tetrahydrobiopterin biosynthetic process / neuron projection terminus / regulation of nitric oxide biosynthetic process / mitogen-activated protein kinase binding / dopamine biosynthetic process / negative regulation of cardiac muscle cell apoptotic process / response to pain / positive regulation of heart rate / response to type II interferon / negative regulation of cellular senescence / response to tumor necrosis factor / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / tetrahydrofolate biosynthetic process / positive regulation of telomere maintenance via telomerase / nitric oxide biosynthetic process / negative regulation of blood pressure / positive regulation of nitric-oxide synthase activity / regulation of blood pressure / vasodilation / positive regulation of neuron apoptotic process / melanosome / cytoplasmic vesicle / protein-containing complex assembly / nuclear membrane / response to lipopolysaccharide / GTPase activity / calcium ion binding / dendrite / protein-containing complex binding / GTP binding / protein homodimerization activity / protein-containing complex / mitochondrion / zinc ion binding / nucleoplasm / identical protein binding / nucleus / cytoplasm / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Ebenhoch R / Nar H | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2020 ジャーナル: Proc Natl Acad Sci U S A / 年: 2020タイトル: A hybrid approach reveals the allosteric regulation of GTP cyclohydrolase I. 著者: Rebecca Ebenhoch / Simone Prinz / Susann Kaltwasser / Deryck J Mills / Robert Meinecke / Martin Rübbelke / Dirk Reinert / Margit Bauer / Lisa Weixler / Markus Zeeb / Janet Vonck / Herbert Nar /  要旨: Guanosine triphosphate (GTP) cyclohydrolase I (GCH1) catalyzes the conversion of GTP to dihydroneopterin triphosphate (H2NTP), the initiating step in the biosynthesis of tetrahydrobiopterin (BH4). ...Guanosine triphosphate (GTP) cyclohydrolase I (GCH1) catalyzes the conversion of GTP to dihydroneopterin triphosphate (H2NTP), the initiating step in the biosynthesis of tetrahydrobiopterin (BH4). Besides other roles, BH4 functions as cofactor in neurotransmitter biosynthesis. The BH4 biosynthetic pathway and GCH1 have been identified as promising targets to treat pain disorders in patients. The function of mammalian GCH1s is regulated by a metabolic sensing mechanism involving a regulator protein, GCH1 feedback regulatory protein (GFRP). GFRP binds to GCH1 to form inhibited or activated complexes dependent on availability of cofactor ligands, BH4 and phenylalanine, respectively. We determined high-resolution structures of human GCH1-GFRP complexes by cryoelectron microscopy (cryo-EM). Cryo-EM revealed structural flexibility of specific and relevant surface lining loops, which previously was not detected by X-ray crystallography due to crystal packing effects. Further, we studied allosteric regulation of isolated GCH1 by X-ray crystallography. Using the combined structural information, we are able to obtain a comprehensive picture of the mechanism of allosteric regulation. Local rearrangements in the allosteric pocket upon BH4 binding result in drastic changes in the quaternary structure of the enzyme, leading to a more compact, tense form of the inhibited protein, and translocate to the active site, leading to an open, more flexible structure of its surroundings. Inhibition of the enzymatic activity is not a result of hindrance of substrate binding, but rather a consequence of accelerated substrate binding kinetics as shown by saturation transfer difference NMR (STD-NMR) and site-directed mutagenesis. We propose a dissociation rate controlled mechanism of allosteric, noncompetitive inhibition. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11113.map.gz emd_11113.map.gz | 5.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11113-v30.xml emd-11113-v30.xml emd-11113.xml emd-11113.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_11113.png emd_11113.png | 131.5 KB | ||
| Filedesc metadata |  emd-11113.cif.gz emd-11113.cif.gz | 6.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11113 http://ftp.pdbj.org/pub/emdb/structures/EMD-11113 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11113 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11113 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_11113_validation.pdf.gz emd_11113_validation.pdf.gz | 401.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_11113_full_validation.pdf.gz emd_11113_full_validation.pdf.gz | 401.5 KB | 表示 | |
| XML形式データ |  emd_11113_validation.xml.gz emd_11113_validation.xml.gz | 6.1 KB | 表示 | |
| CIF形式データ |  emd_11113_validation.cif.gz emd_11113_validation.cif.gz | 6.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11113 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11113 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11113 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11113 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6z80MC  6z85C  6z86C  6z87C  6z88C  6z89C  7accC  7al9C  7alaC  7albC  7alcC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11113.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11113.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.077 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : stimulatory GCH1-GFRP complex (Phenylalanine and 8-oxo-GTP bound)
| 全体 | 名称: stimulatory GCH1-GFRP complex (Phenylalanine and 8-oxo-GTP bound) |
|---|---|
| 要素 |
|
-超分子 #1: stimulatory GCH1-GFRP complex (Phenylalanine and 8-oxo-GTP bound)
| 超分子 | 名称: stimulatory GCH1-GFRP complex (Phenylalanine and 8-oxo-GTP bound) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 353 KDa |
-分子 #1: GTP cyclohydrolase 1
| 分子 | 名称: GTP cyclohydrolase 1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 10 / 光学異性体: LEVO / EC番号: GTP cyclohydrolase I |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 25.32492 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MHHHHHHGSD DDDKRPEAKS AQPADGWKGE RPRSEEDNEL NLPNLAAAYS SILSSLGENP QRQGLLKTPW RAASAMQFFT KGYQETISD VLNDAIFDED HDEMVIVKDI DMFSMCEHHL VPFVGKVHIG YLPNKQVLGL SKLARIVEIY SRRLQVQERL T KQIAVAIT ...文字列: MHHHHHHGSD DDDKRPEAKS AQPADGWKGE RPRSEEDNEL NLPNLAAAYS SILSSLGENP QRQGLLKTPW RAASAMQFFT KGYQETISD VLNDAIFDED HDEMVIVKDI DMFSMCEHHL VPFVGKVHIG YLPNKQVLGL SKLARIVEIY SRRLQVQERL T KQIAVAIT EALRPAGVGV VVEATHMCMV MRGVQKMNSK TVTSTMLGVF REDPKTREEF LTLIRS UniProtKB: GTP cyclohydrolase 1 |
-分子 #2: GTP cyclohydrolase 1 feedback regulatory protein
| 分子 | 名称: GTP cyclohydrolase 1 feedback regulatory protein / タイプ: protein_or_peptide / ID: 2 / コピー数: 10 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 9.992483 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: GSHMPYLLIS TQIRMEVGPT MVGDEQSDPE LMQHLGASKR RALGNNFYEY YVDDPPRIVL DKLERRGFRV LSMTGVGQTL VWCLHKE UniProtKB: GTP cyclohydrolase 1 feedback regulatory protein |
-分子 #3: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 3 / コピー数: 10 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-分子 #4: PHENYLALANINE
| 分子 | 名称: PHENYLALANINE / タイプ: ligand / ID: 4 / コピー数: 10 / 式: PHE |
|---|---|
| 分子量 | 理論値: 165.189 Da |
| Chemical component information | 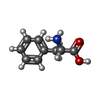 ChemComp-PHE: |
-分子 #5: 8-OXO-GUANOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: 8-OXO-GUANOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 5 / コピー数: 10 / 式: 8GT |
|---|---|
| 分子量 | 理論値: 539.18 Da |
| Chemical component information |  ChemComp-8GT: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.6 mg/mL | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 5.5 構成要素:
| |||||||||||||||
| グリッド | モデル: C-flat-1.2/1.3 / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE | |||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 実像数: 3121 / 平均露光時間: 8.0 sec. / 平均電子線量: 55.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 130000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
















