+Search query
-Structure paper
| Title | Structural insights into lipid chain-length selectivity and allosteric regulation of FFA2. |
|---|---|
| Journal, issue, pages | Nat Commun, Vol. 16, Issue 1, Page 2809, Year 2025 |
| Publish date | Mar 26, 2025 |
 Authors Authors | Mai Kugawa / Kouki Kawakami / Ryoji Kise / Carl-Mikael Suomivuori / Masaki Tsujimura / Kazuhiro Kobayashi / Asato Kojima / Wakana J Inoue / Masahiro Fukuda / Toshiki E Matsui / Ayami Fukunaga / Junki Koyanagi / Suhyang Kim / Hisako Ikeda / Keitaro Yamashita / Keisuke Saito / Hiroshi Ishikita / Ron O Dror / Asuka Inoue / Hideaki E Kato /   |
| PubMed Abstract | The free fatty acid receptor 2 (FFA2) is a G protein-coupled receptor (GPCR) that selectively recognizes short-chain fatty acids to regulate metabolic and immune functions. As a promising therapeutic ...The free fatty acid receptor 2 (FFA2) is a G protein-coupled receptor (GPCR) that selectively recognizes short-chain fatty acids to regulate metabolic and immune functions. As a promising therapeutic target, FFA2 has been the focus of intensive development of synthetic ligands. However, the mechanisms by which endogenous and synthetic ligands modulate FFA2 activity remain unclear. Here, we present the structures of the human FFA2-Gi complex activated by the synthetic orthosteric agonist TUG-1375 and the positive allosteric modulator/allosteric agonist 4-CMTB, along with the structure of the inactive FFA2 bound to the antagonist GLPG0974. Structural comparisons with FFA1 and mutational studies reveal how FFA2 selects specific fatty acid chain lengths. Moreover, our structures reveal that GLPG0974 functions as an allosteric antagonist by binding adjacent to the orthosteric pocket to block agonist binding, whereas 4-CMTB binds the outer surface of transmembrane helices 6 and 7 to directly activate the receptor. Supported by computational and functional studies, these insights illuminate diverse mechanisms of ligand action, paving the way for precise GPCR-targeted drug design. |
 External links External links |  Nat Commun / Nat Commun /  PubMed:40140663 / PubMed:40140663 /  PubMed Central PubMed Central |
| Methods | EM (single particle) |
| Resolution | 3.19 - 3.36 Å |
| Structure data | EMDB-39003, PDB-8y6w: EMDB-39004, PDB-8y6y: |
| Chemicals | 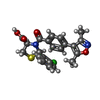 ChemComp-9UJ:  PDB-1lyc:  PDB-1lyd: |
| Source |
|
 Keywords Keywords | MEMBRANE PROTEIN / GPCR |
 Movie
Movie Controller
Controller Structure viewers
Structure viewers About Yorodumi Papers
About Yorodumi Papers







 homo sapiens (human)
homo sapiens (human)
