+検索条件
-Structure paper
| タイトル | Molecular mechanism of the wake-promoting agent TAK-925. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 13, Issue 1, Page 2902, Year 2022 |
| 掲載日 | 2022年5月25日 |
 著者 著者 | Jie Yin / Yanyong Kang / Aaron P McGrath / Karen Chapman / Megan Sjodt / Eiji Kimura / Atsutoshi Okabe / Tatsuki Koike / Yuhei Miyanohana / Yuji Shimizu / Rameshu Rallabandi / Peng Lian / Xiaochen Bai / Mack Flinspach / Jef K De Brabander / Daniel M Rosenbaum /    |
| PubMed 要旨 | The OX orexin receptor (OXR) is a highly expressed G protein-coupled receptor (GPCR) in the brain that regulates wakefulness and circadian rhythms in humans. Antagonism of OXR is a proven therapeutic ...The OX orexin receptor (OXR) is a highly expressed G protein-coupled receptor (GPCR) in the brain that regulates wakefulness and circadian rhythms in humans. Antagonism of OXR is a proven therapeutic strategy for insomnia drugs, and agonism of OXR is a potentially powerful approach for narcolepsy type 1, which is characterized by the death of orexinergic neurons. Until recently, agonism of OXR had been considered 'undruggable.' We harness cryo-electron microscopy of OXR-G protein complexes to determine how the first clinically tested OXR agonist TAK-925 can activate OXR in a highly selective manner. Two structures of TAK-925-bound OXR with either a G mimetic or G reveal that TAK-925 binds at the same site occupied by antagonists, yet interacts with the transmembrane helices to trigger activating microswitches. Our structural and mutagenesis data show that TAK-925's selectivity is mediated by subtle differences between OX and OX receptor subtypes at the orthosteric pocket. Finally, differences in the polarity of interactions at the G protein binding interfaces help to rationalize OXR's coupling selectivity for G signaling. The mechanisms of TAK-925's binding, activation, and selectivity presented herein will aid in understanding the efficacy of small molecule OXR agonists for narcolepsy and other circadian disorders. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:35614071 / PubMed:35614071 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.17 - 3.3 Å |
| 構造データ | EMDB-25389, PDB-7sqo: EMDB-25399, PDB-7sr8: |
| 化合物 | 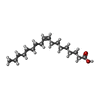 ChemComp-OLA: 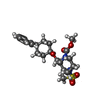 ChemComp-A6F: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN / CLASS A GPCR / SIGNALING PROTEIN / orexin / GPCR / narcolepsy |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について







 homo sapiens (ヒト)
homo sapiens (ヒト)
