+検索条件
-Structure paper
| タイトル | High-resolution snapshots of human N-myristoyltransferase in action illuminate a mechanism promoting N-terminal Lys and Gly myristoylation. |
|---|---|
| ジャーナル・号・ページ | Nat Commun, Vol. 11, Page 1132-1132, Year 2020 |
| 掲載日 | 2017年9月13日 (構造データの登録日) |
 著者 著者 | Dian, C. / Perez-Dorado, I. / Riviere, F. / Asensio, T. / Legrand, P. / Ritzefeld, M. / Shen, M. / Cota, E. / Meinnel, T. / Tate, E.W. / Giglione, C. |
 リンク リンク |  Nat Commun / Nat Commun /  PubMed:32111831 PubMed:32111831 |
| 手法 | X線回折 |
| 解像度 | 1.87 - 2.8 Å |
| 構造データ |  PDB-6ehj:  PDB-6qrm:  PDB-6sjz:  PDB-6sk2:  PDB-6sk3:  PDB-6sk8:  PDB-6skj: |
| 化合物 |  ChemComp-GOL:  ChemComp-MYA:  ChemComp-GLY:  ChemComp-SER: 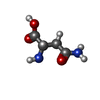 ChemComp-ASN: 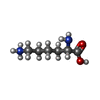 ChemComp-LYS: 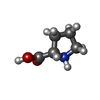 ChemComp-PRO: 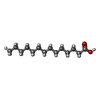 ChemComp-MYR:  ChemComp-COA:  ChemComp-HOH:  ChemComp-CL:  ChemComp-MG: |
| 由来 |
|
 キーワード キーワード | TRANSFERASE / Myristoylation / complex / substrate peptide / Myristoyltransferase type1 / Acyltransferase / GNAT / GCN5-Related N-Acetyltransferases / NMT / E-MYRISTOYLATION |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



 homo sapiens (ヒト)
homo sapiens (ヒト)