+検索条件
-Structure paper
| タイトル | The allosteric control mechanism of bacterial glycogen biosynthesis disclosed by cryoEM. |
|---|---|
| ジャーナル・号・ページ | Curr Res Struct Biol, Vol. 2, Page 89-8103, Year 2020 |
| 掲載日 | 2020年5月1日 |
 著者 著者 | Javier O Cifuente / Natalia Comino / Cecilia D'Angelo / Alberto Marina / David Gil-Carton / David Albesa-Jové / Marcelo E Guerin /  |
| PubMed 要旨 | Glycogen and starch are the major carbon and energy reserve polysaccharides in nature, providing living organisms with a survival advantage. The evolution of the enzymatic machinery responsible for ...Glycogen and starch are the major carbon and energy reserve polysaccharides in nature, providing living organisms with a survival advantage. The evolution of the enzymatic machinery responsible for the biosynthesis and degradation of such polysaccharides, led the development of mechanisms to control the assembly and disassembly rate, to store and recover glucose according to cell energy demands. The tetrameric enzyme ADP-glucose pyrophosphorylase (AGPase) catalyzes and regulates the initial step in the biosynthesis of both α-polyglucans. AGPase displays cooperativity and allosteric regulation by sensing metabolites from the cell energy flux. The understanding of the allosteric signal transduction mechanisms in AGPase arises as a long-standing challenge. In this work, we disclose the cryoEM structures of the paradigmatic homotetrameric AGPase from (AGPase), in complex with either positive or negative physiological allosteric regulators, fructose-1,6-bisphosphate (FBP) and AMP respectively, both at 3.0 Å resolution. Strikingly, the structures reveal that FBP binds deeply into the allosteric cleft and overlaps the AMP site. As a consequence, FBP promotes a concerted conformational switch of a regulatory loop, RL2, from a "locked" to a "free" state, modulating ATP binding and activating the enzyme. This notion is strongly supported by our complementary biophysical and bioinformatics evidence, and a careful analysis of vast enzyme kinetics data on single-point mutants of AGPase. The cryoEM structures uncover the residue interaction networks (RIN) between the allosteric and the catalytic components of the enzyme, providing unique details on how the signaling information is transmitted across the tetramer, from which cooperativity emerges. Altogether, the conformational states visualized by cryoEM reveal the regulatory mechanism of AGPase, laying the foundations to understand the allosteric control of bacterial glycogen biosynthesis at the molecular level of detail. |
 リンク リンク |  Curr Res Struct Biol / Curr Res Struct Biol /  PubMed:34235472 / PubMed:34235472 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.2 - 3.4 Å |
| 構造データ | EMDB-10199, PDB-6shj: EMDB-10201, PDB-6shn: EMDB-10203, PDB-6shq: EMDB-10208, PDB-6si8: |
| 化合物 | 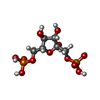 ChemComp-FBP: 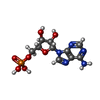 ChemComp-AMP: |
| 由来 |
|
 キーワード キーワード |  TRANSFERASE (転移酵素) / ADP-glucose pyrophosphorilase Complex with FBP activator / ADP-glucose pyrophosphorilase Complex with AMP inhibitor TRANSFERASE (転移酵素) / ADP-glucose pyrophosphorilase Complex with FBP activator / ADP-glucose pyrophosphorilase Complex with AMP inhibitor |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について












