+検索条件
-Structure paper
| タイトル | Fluoxetine targets an allosteric site in the enterovirus 2C AAA+ ATPase and stabilizes a ring-shaped hexameric complex. |
|---|---|
| ジャーナル・号・ページ | Sci Adv, Vol. 8, Issue 1, Page eabj7615, Year 2022 |
| 掲載日 | 2022年1月7日 |
 著者 著者 | Daniel L Hurdiss / Priscila El Kazzi / Lisa Bauer / Nicolas Papageorgiou / François P Ferron / Tim Donselaar / Arno L W van Vliet / Tatiana M Shamorkina / Joost Snijder / Bruno Canard / Etienne Decroly / Andrea Brancale / Tzviya Zeev-Ben-Mordehai / Friedrich Förster / Frank J M van Kuppeveld / Bruno Coutard /    |
| PubMed 要旨 | Enteroviruses are globally prevalent human pathogens responsible for many diseases. The nonstructural protein 2C is a AAA+ helicase and plays a key role in enterovirus replication. Drug repurposing ...Enteroviruses are globally prevalent human pathogens responsible for many diseases. The nonstructural protein 2C is a AAA+ helicase and plays a key role in enterovirus replication. Drug repurposing screens identified 2C-targeting compounds such as fluoxetine and dibucaine, but how they inhibit 2C is unknown. Here, we present a crystal structure of the soluble and monomeric fragment of coxsackievirus B3 2C protein in complex with ()-fluoxetine (SFX), revealing an allosteric binding site. To study the functional consequences of SFX binding, we engineered an adenosine triphosphatase (ATPase)–competent, hexameric 2C protein. Using this system, we show that SFX, dibucaine, HBB [2-(α-hydroxybenzyl)-benzimidazole], and guanidine hydrochloride inhibit 2C ATPase activity. Moreover, cryo–electron microscopy analysis demonstrated that SFX and dibucaine lock 2C in a defined hexameric state, rationalizing their mode of inhibition. Collectively, these results provide important insights into 2C inhibition and a robust engineering strategy for structural, functional, and drug-screening analysis of 2C proteins. |
 リンク リンク |  Sci Adv / Sci Adv /  PubMed:34985963 / PubMed:34985963 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) / X線回折 |
| 解像度 | 1.52 - 12.0 Å |
| 構造データ |  EMDB-12798:  PDB-6s3a:  PDB-6t3w: |
| 化合物 | 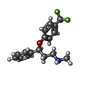 ChemComp-SFX:  ChemComp-ZN:  ChemComp-CL:  ChemComp-HOH:  ChemComp-SO4:  ChemComp-NA: |
| 由来 |
|
 キーワード キーワード | VIRAL PROTEIN / 2C / enterovirus / helicase / ATPase / complex / antiviral / Porzac / fluoxetine / repurposing / coxsackievirus |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



 Coxsackievirus B3 (strain Nancy) (コクサッキーウイルス)
Coxsackievirus B3 (strain Nancy) (コクサッキーウイルス) coxsackievirus b3 (コクサッキーウイルス)
coxsackievirus b3 (コクサッキーウイルス)