+検索条件
-Structure paper
| タイトル | Positive allosteric mechanisms of adenosine A receptor-mediated analgesia. |
|---|---|
| ジャーナル・号・ページ | Nature, Vol. 597, Issue 7877, Page 571-576, Year 2021 |
| 掲載日 | 2021年9月8日 |
 著者 著者 | Christopher J Draper-Joyce / Rebecca Bhola / Jinan Wang / Apurba Bhattarai / Anh T N Nguyen / India Cowie-Kent / Kelly O'Sullivan / Ling Yeong Chia / Hariprasad Venugopal / Celine Valant / David M Thal / Denise Wootten / Nicolas Panel / Jens Carlsson / Macdonald J Christie / Paul J White / Peter Scammells / Lauren T May / Patrick M Sexton / Radostin Danev / Yinglong Miao / Alisa Glukhova / Wendy L Imlach / Arthur Christopoulos /     |
| PubMed 要旨 | The adenosine A receptor (AR) is a promising therapeutic target for non-opioid analgesic agents to treat neuropathic pain. However, development of analgesic orthosteric AR agonists has failed because ...The adenosine A receptor (AR) is a promising therapeutic target for non-opioid analgesic agents to treat neuropathic pain. However, development of analgesic orthosteric AR agonists has failed because of a lack of sufficient on-target selectivity as well as off-tissue adverse effects. Here we show that [2-amino-4-(3,5-bis(trifluoromethyl)phenyl)thiophen-3-yl)(4-chlorophenyl)methanone] (MIPS521), a positive allosteric modulator of the AR, exhibits analgesic efficacy in rats in vivo through modulation of the increased levels of endogenous adenosine that occur in the spinal cord of rats with neuropathic pain. We also report the structure of the AR co-bound to adenosine, MIPS521 and a G heterotrimer, revealing an extrahelical lipid-detergent-facing allosteric binding pocket that involves transmembrane helixes 1, 6 and 7. Molecular dynamics simulations and ligand kinetic binding experiments support a mechanism whereby MIPS521 stabilizes the adenosine-receptor-G protein complex. This study provides proof of concept for structure-based allosteric drug design of non-opioid analgesic agents that are specific to disease contexts. |
 リンク リンク |  Nature / Nature /  PubMed:34497422 / PubMed:34497422 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.2 - 3.3 Å |
| 構造データ | EMDB-23280, PDB-7ld3: EMDB-23281, PDB-7ld4: |
| 化合物 | 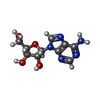 ChemComp-ADN: 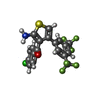 ChemComp-XTD:  ChemComp-HOH: |
| 由来 |
|
 キーワード キーワード |  SIGNALING PROTEIN / SIGNALING PROTEIN /  membrane protein (膜タンパク質) / active-state G protein-coupled receptor / membrane protein (膜タンパク質) / active-state G protein-coupled receptor /  adenosine A1 receptor / PAM / adenosine A1 receptor / PAM /  allosteric modulator (アロステリック調節因子) allosteric modulator (アロステリック調節因子) |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について








