+検索条件
-Structure paper
| タイトル | Structural mechanisms for the activation of human cardiac KCNQ1 channel by electro-mechanical coupling enhancers. |
|---|---|
| ジャーナル・号・ページ | Proc Natl Acad Sci U S A, Vol. 119, Issue 45, Page e2207067119, Year 2022 |
| 掲載日 | 2022年11月8日 |
 著者 著者 | Demin Ma / Ling Zhong / Zhenzhen Yan / Jing Yao / Yan Zhang / Fan Ye / Yuan Huang / Dongwu Lai / Wei Yang / Panpan Hou / Jiangtao Guo /  |
| PubMed 要旨 | The cardiac KCNQ1 potassium channel carries the important current and controls the heart rhythm. Hundreds of mutations in KCNQ1 can cause life-threatening cardiac arrhythmia. Although KCNQ1 ...The cardiac KCNQ1 potassium channel carries the important current and controls the heart rhythm. Hundreds of mutations in KCNQ1 can cause life-threatening cardiac arrhythmia. Although KCNQ1 structures have been recently resolved, the structural basis for the dynamic electro-mechanical coupling, also known as the voltage sensor domain-pore domain (VSD-PD) coupling, remains largely unknown. In this study, utilizing two VSD-PD coupling enhancers, namely, the membrane lipid phosphatidylinositol 4,5-bisphosphate (PIP) and a small-molecule ML277, we determined 2.5-3.5 Å resolution cryo-electron microscopy structures of full-length human KCNQ1-calmodulin (CaM) complex in the apo closed, ML277-bound open, and ML277-PIP-bound open states. ML277 binds at the "elbow" pocket above the S4-S5 linker and directly induces an upward movement of the S4-S5 linker and the opening of the activation gate without affecting the C-terminal domain (CTD) of KCNQ1. PIP binds at the cleft between the VSD and the PD and brings a large structural rearrangement of the CTD together with the CaM to activate the PD. These findings not only elucidate the structural basis for the dynamic VSD-PD coupling process during KCNQ1 gating but also pave the way to develop new therapeutics for anti-arrhythmia. |
 リンク リンク |  Proc Natl Acad Sci U S A / Proc Natl Acad Sci U S A /  PubMed:36763058 / PubMed:36763058 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.5 - 3.5 Å |
| 構造データ | EMDB-33316, PDB-7xni: EMDB-33317, PDB-7xnk: EMDB-33318, PDB-7xnl: EMDB-33319, PDB-7xnn: |
| 化合物 |  ChemComp-K: 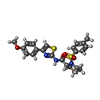 ChemComp-I0S: 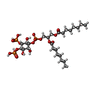 ChemComp-PIO: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN / potassium voltage-gated channel / ML277 / PIP2 |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について











 homo sapiens (ヒト)
homo sapiens (ヒト)