+検索条件
-Structure paper
| タイトル | Structure of the human dopamine transporter and mechanisms of inhibition. |
|---|---|
| ジャーナル・号・ページ | Nature, Vol. 632, Issue 8025, Page 672-677, Year 2024 |
| 掲載日 | 2024年8月7日 |
 著者 著者 | Dushyant Kumar Srivastava / Vikas Navratna / Dilip K Tosh / Audrey Chinn / Md Fulbabu Sk / Emad Tajkhorshid / Kenneth A Jacobson / Eric Gouaux /  |
| PubMed 要旨 | The neurotransmitter dopamine has central roles in mood, appetite, arousal and movement. Despite its importance in brain physiology and function, and as a target for illicit and therapeutic drugs, ...The neurotransmitter dopamine has central roles in mood, appetite, arousal and movement. Despite its importance in brain physiology and function, and as a target for illicit and therapeutic drugs, the human dopamine transporter (hDAT) and mechanisms by which it is inhibited by small molecules and Zn are without a high-resolution structural context. Here we determine the structure of hDAT in a tripartite complex with the competitive inhibitor and cocaine analogue, (-)-2-β-carbomethoxy-3-β-(4-fluorophenyl)tropane (β-CFT), the non-competitive inhibitor MRS7292 and Zn (ref. ). We show how β-CFT occupies the central site, approximately halfway across the membrane, stabilizing the transporter in an outward-open conformation. MRS7292 binds to a structurally uncharacterized allosteric site, adjacent to the extracellular vestibule, sequestered underneath the extracellular loop 4 (EL4) and adjacent to transmembrane helix 1b (TM1b), acting as a wedge, precluding movement of TM1b and closure of the extracellular gate. A Zn ion further stabilizes the outward-facing conformation by coupling EL4 to EL2, TM7 and TM8, thus providing specific insights into how Zn restrains the movement of EL4 relative to EL2 and inhibits transport activity. |
 リンク リンク |  Nature / Nature /  PubMed:39112705 / PubMed:39112705 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.19 Å |
| 構造データ | EMDB-43128, PDB-8vby: |
| 化合物 | 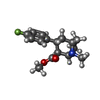 ChemComp-42L:  PDB-1aaf:  ChemComp-NAG: 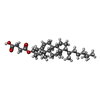 ChemComp-Y01: 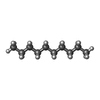 ChemComp-D10: 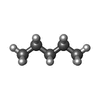 ChemComp-LNK:  ChemComp-HP6:  ChemComp-ZN:  ChemComp-NA:  ChemComp-D12:  ChemComp-MYS:  ChemComp-OCT:  ChemComp-HOH: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN / Transport / Membrane / Inhibitor |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について





 homo sapiens (ヒト)
homo sapiens (ヒト)