+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of G6PD-D200N tetramer bound to NADP+ and G6P | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of protein glutathionylation / pentose biosynthetic process / ribose phosphate biosynthetic process / glucose-6-phosphate dehydrogenase (NADP+) / positive regulation of calcium ion transmembrane transport via high voltage-gated calcium channel / pentose-phosphate shunt, oxidative branch /  glucose-6-phosphate dehydrogenase activity / response to iron(III) ion / glucose-6-phosphate dehydrogenase activity / response to iron(III) ion /  ペントースリン酸経路 / NADPH regeneration ...negative regulation of protein glutathionylation / pentose biosynthetic process / ribose phosphate biosynthetic process / glucose-6-phosphate dehydrogenase (NADP+) / positive regulation of calcium ion transmembrane transport via high voltage-gated calcium channel / pentose-phosphate shunt, oxidative branch / ペントースリン酸経路 / NADPH regeneration ...negative regulation of protein glutathionylation / pentose biosynthetic process / ribose phosphate biosynthetic process / glucose-6-phosphate dehydrogenase (NADP+) / positive regulation of calcium ion transmembrane transport via high voltage-gated calcium channel / pentose-phosphate shunt, oxidative branch /  glucose-6-phosphate dehydrogenase activity / response to iron(III) ion / glucose-6-phosphate dehydrogenase activity / response to iron(III) ion /  ペントースリン酸経路 / NADPH regeneration / negative regulation of cell growth involved in cardiac muscle cell development / glucose 6-phosphate metabolic process / NADP metabolic process / pentose-phosphate shunt / ペントースリン酸経路 / NADPH regeneration / negative regulation of cell growth involved in cardiac muscle cell development / glucose 6-phosphate metabolic process / NADP metabolic process / pentose-phosphate shunt /  D-glucose binding / NFE2L2 regulates pentose phosphate pathway genes / response to food / cholesterol biosynthetic process / erythrocyte maturation / centriolar satellite / negative regulation of reactive oxygen species metabolic process / glutathione metabolic process / regulation of neuron apoptotic process / substantia nigra development / TP53 Regulates Metabolic Genes / lipid metabolic process / cytoplasmic side of plasma membrane / response to organic cyclic compound / glucose metabolic process / cellular response to oxidative stress / D-glucose binding / NFE2L2 regulates pentose phosphate pathway genes / response to food / cholesterol biosynthetic process / erythrocyte maturation / centriolar satellite / negative regulation of reactive oxygen species metabolic process / glutathione metabolic process / regulation of neuron apoptotic process / substantia nigra development / TP53 Regulates Metabolic Genes / lipid metabolic process / cytoplasmic side of plasma membrane / response to organic cyclic compound / glucose metabolic process / cellular response to oxidative stress /  NADP binding / response to ethanol / intracellular membrane-bounded organelle / protein homodimerization activity / extracellular exosome / NADP binding / response to ethanol / intracellular membrane-bounded organelle / protein homodimerization activity / extracellular exosome /  生体膜 / identical protein binding / 生体膜 / identical protein binding /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.5 Å クライオ電子顕微鏡法 / 解像度: 2.5 Å | |||||||||
 データ登録者 データ登録者 | Wei X / Marmorstein R | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: Allosteric role of a structural NADP molecule in glucose-6-phosphate dehydrogenase activity. 著者: Xuepeng Wei / Kathryn Kixmoeller / Elana Baltrusaitis / Xiaolu Yang / Ronen Marmorstein /  要旨: Human glucose-6-phosphate dehydrogenase (G6PD) is the main cellular source of NADPH, and thus plays a key role in maintaining reduced glutathione to protect cells from oxidative stress disorders such ...Human glucose-6-phosphate dehydrogenase (G6PD) is the main cellular source of NADPH, and thus plays a key role in maintaining reduced glutathione to protect cells from oxidative stress disorders such as hemolytic anemia. G6PD is a multimeric enzyme that uses the cofactors β-D-glucose 6-phosphate (G6P) and "catalytic" NADP (NADPc), as well as a "structural" NADP (NADPs) located ∼25 Å from the active site, to generate NADPH. While X-ray crystallographic and biochemical studies have revealed a role for NADPs in maintaining the catalytic activity by stabilizing the multimeric G6PD conformation, other potential roles for NADPs have not been evaluated. Here, we determined the high resolution cryo-electron microscopy structures of human wild-type G6PD in the absence of bound ligands and a catalytic G6PD-D200N mutant bound to NADPc and NADPs in the absence or presence of G6P. A comparison of these structures, together with previously reported structures, reveals that the unliganded human G6PD forms a mixture of dimers and tetramers with similar overall folds, and binding of NADPs induces a structural ordering of a C-terminal extension region and allosterically regulates G6P binding and catalysis. These studies have implications for understanding G6PD deficiencies and for therapy of G6PD-mediated disorders. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25227.map.gz emd_25227.map.gz | 20.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25227-v30.xml emd-25227-v30.xml emd-25227.xml emd-25227.xml | 11 KB 11 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_25227.png emd_25227.png | 160.3 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25227 http://ftp.pdbj.org/pub/emdb/structures/EMD-25227 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25227 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25227 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7sniMC  7snfC  7sngC  7snhC  7toeC  7tofC  7ualC  7uc2C M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25227.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25227.map.gz / 形式: CCP4 / 大きさ: 22.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.83 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : G6PD protein
| 全体 | 名称: G6PD protein グルコース-6-リン酸デヒドロゲナーゼ グルコース-6-リン酸デヒドロゲナーゼ |
|---|---|
| 要素 |
|
-超分子 #1: G6PD protein
| 超分子 | 名称: G6PD protein / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 110 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
-分子 #1: Glucose-6-phosphate 1-dehydrogenase
| 分子 | 名称: Glucose-6-phosphate 1-dehydrogenase / タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO / EC番号: glucose-6-phosphate dehydrogenase (NADP+) |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 60.402762 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MAEQVALSRT QVCGILREEL FQGDAFHQSD THIFIIMGAS GDLAKKKIYP TIWWLFRDGL LPENTFIVGY ARSRLTVADI RKQSEPFFK ATPEEKLKLE DFFARNSYVA GQYDDAASYQ RLNSHMNALH LGSQANRLFY LALPPTVYEA VTKNIHESCM S QIGWNRII ...文字列: MAEQVALSRT QVCGILREEL FQGDAFHQSD THIFIIMGAS GDLAKKKIYP TIWWLFRDGL LPENTFIVGY ARSRLTVADI RKQSEPFFK ATPEEKLKLE DFFARNSYVA GQYDDAASYQ RLNSHMNALH LGSQANRLFY LALPPTVYEA VTKNIHESCM S QIGWNRII VEKPFGRDLQ SSDRLSNHIS SLFREDQIYR INHYLGKEMV QNLMVLRFAN RIFGPIWNRD NIACVILTFK EP FGTEGRG GYFDEFGIIR DVMQNHLLQM LCLVAMEKPA STNSDDVRDE KVKVLKCISE VQANNVVLGQ YVGNPDGEGE ATK GYLDDP TVPRGSTTAT FAAVVLYVEN ERWDGVPFIL RCGKALNERK AEVRLQFHDV AGDIFHQQCK RNELVIRVQP NEAV YTKMM TKKPGMFFNP EESELDLTYG NRYKNVKLPD AYERLILDVF CGSQMHFVRS DELREAWRIF TPLLHQIELE KPKPI PYIY GSRGPTEADE LMKRVGFQYE GTYKWVNPHK LLEHHHHHH |
-分子 #2: NADP NICOTINAMIDE-ADENINE-DINUCLEOTIDE PHOSPHATE
| 分子 | 名称: NADP NICOTINAMIDE-ADENINE-DINUCLEOTIDE PHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 8 / 式: NAP |
|---|---|
| 分子量 | 理論値: 743.405 Da |
| Chemical component information |  ChemComp-NAP: |
-分子 #3: 6-O-phosphono-beta-D-glucopyranose
| 分子 | 名称: 6-O-phosphono-beta-D-glucopyranose / タイプ: ligand / ID: 3 / コピー数: 4 / 式: BG6 |
|---|---|
| 分子量 | 理論値: 260.136 Da |
| Chemical component information | 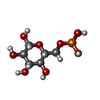 ChemComp-BG6: |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 233 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 40.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 2.5 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 67823 |
 ムービー
ムービー コントローラー
コントローラー












