+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
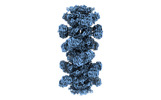
| タイトル | Helical structure of BcThsA in complex with 1''-3'gc(etheno)ADPR | |||||||||
 マップデータ マップデータ | Sharpened EM map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Thoeris /  SIR2 domain / SIR2 domain /  SLOG domain / 3'cADPR / SLOG domain / 3'cADPR /  HYDROLASE (加水分解酵素) HYDROLASE (加水分解酵素) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |   Bacillus cereus (セレウス菌) / Bacillus cereus (セレウス菌) /   Bacillus cereus MSX-D12 (セレウス菌) Bacillus cereus MSX-D12 (セレウス菌) | |||||||||
| 手法 | らせん対称体再構成法 /  クライオ電子顕微鏡法 / 解像度: 2.75 Å クライオ電子顕微鏡法 / 解像度: 2.75 Å | |||||||||
 データ登録者 データ登録者 | Tamulaitiene G / Sasnauskas G / Sabonis D | |||||||||
| 資金援助 | リトアニア, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Activation of Thoeris antiviral system via SIR2 effector filament assembly. 著者: Giedre Tamulaitiene / Dziugas Sabonis / Giedrius Sasnauskas / Audrone Ruksenaite / Arunas Silanskas / Carmel Avraham / Gal Ofir / Rotem Sorek / Mindaugas Zaremba / Virginijus Siksnys /   要旨: To survive bacteriophage (phage) infections, bacteria developed numerous anti-phage defence systems. Some of them (for example, type III CRISPR-Cas, CBASS, Pycsar and Thoeris) consist of two modules: ...To survive bacteriophage (phage) infections, bacteria developed numerous anti-phage defence systems. Some of them (for example, type III CRISPR-Cas, CBASS, Pycsar and Thoeris) consist of two modules: a sensor responsible for infection recognition and an effector that stops viral replication by destroying key cellular components. In the Thoeris system, a Toll/interleukin-1 receptor (TIR)-domain protein, ThsB, acts as a sensor that synthesizes an isomer of cyclic ADP ribose, 1''-3' glycocyclic ADP ribose (gcADPR), which is bound in the Smf/DprA-LOG (SLOG) domain of the ThsA effector and activates the silent information regulator 2 (SIR2)-domain-mediated hydrolysis of a key cell metabolite, NAD (refs. ). Although the structure of ThsA has been solved, the ThsA activation mechanism remained incompletely understood. Here we show that 1''-3' gcADPR, synthesized in vitro by the dimeric ThsB' protein, binds to the ThsA SLOG domain, thereby activating ThsA by triggering helical filament assembly of ThsA tetramers. The cryogenic electron microscopy (cryo-EM) structure of activated ThsA revealed that filament assembly stabilizes the active conformation of the ThsA SIR2 domain, enabling rapid NAD depletion. Furthermore, we demonstrate that filament formation enables a switch-like response of ThsA to the 1''-3' gcADPR signal. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16234.map.gz emd_16234.map.gz | 117.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16234-v30.xml emd-16234-v30.xml emd-16234.xml emd-16234.xml | 27.8 KB 27.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16234_fsc.xml emd_16234_fsc.xml | 14.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16234.png emd_16234.png | 53.2 KB | ||
| マスクデータ |  emd_16234_msk_1.map emd_16234_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-16234.cif.gz emd-16234.cif.gz | 6.6 KB | ||
| その他 |  emd_16234_additional_1.map.gz emd_16234_additional_1.map.gz emd_16234_additional_2.map.gz emd_16234_additional_2.map.gz emd_16234_additional_3.map.gz emd_16234_additional_3.map.gz emd_16234_additional_4.map.gz emd_16234_additional_4.map.gz emd_16234_additional_5.map.gz emd_16234_additional_5.map.gz emd_16234_half_map_1.map.gz emd_16234_half_map_1.map.gz emd_16234_half_map_2.map.gz emd_16234_half_map_2.map.gz | 117.1 MB 62 MB 60.2 MB 115.1 MB 115.1 MB 115.8 MB 115.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16234 http://ftp.pdbj.org/pub/emdb/structures/EMD-16234 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16234 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16234 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16234.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16234.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Sharpened EM map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_16234_msk_1.map emd_16234_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Local refinement (mask on A subunit) sharpened map...
| ファイル | emd_16234_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refinement (mask on A subunit) sharpened map resampled on main EM map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Unsharpened EM map
| ファイル | emd_16234_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Unsharpened EM map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Local refinement (mask on A subunit) map resampled on main EM map
| ファイル | emd_16234_additional_3.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refinement (mask on A subunit) map resampled on main EM map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Local refinement (mask on A subunit) EM half...
| ファイル | emd_16234_additional_4.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refinement (mask on A subunit) EM half map resampled on main EM map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-追加マップ: Local refinement (mask on A subunit) EM half...
| ファイル | emd_16234_additional_5.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refinement (mask on A subunit) EM half map resampled on main EM map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_16234_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_16234_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : BcThsA in complex with 1''-3'gc(etheno)ADPR
| 全体 | 名称: BcThsA in complex with 1''-3'gc(etheno)ADPR |
|---|---|
| 要素 |
|
-超分子 #1: BcThsA in complex with 1''-3'gc(etheno)ADPR
| 超分子 | 名称: BcThsA in complex with 1''-3'gc(etheno)ADPR / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Bacillus cereus (セレウス菌) Bacillus cereus (セレウス菌) |
-分子 #1: NAD(+) hydrolase ThsA
| 分子 | 名称: NAD(+) hydrolase ThsA / タイプ: protein_or_peptide / ID: 1 / コピー数: 12 / 光学異性体: LEVO / EC番号:  NAD+ヌクレオシダーゼ NAD+ヌクレオシダーゼ |
|---|---|
| 由来(天然) | 生物種:   Bacillus cereus MSX-D12 (セレウス菌) Bacillus cereus MSX-D12 (セレウス菌) |
| 分子量 | 理論値: 55.417746 KDa |
| 組換発現 | 生物種:   Escherichia coli BL21(DE3) (大腸菌) Escherichia coli BL21(DE3) (大腸菌) |
| 配列 | 文字列: SGGMKMNPIV ELFIKDFTKE VMEENAAIFA GAGLSMSVGY VSWAKLLEPI AQEIGLDVNK ENDLVSLAQY YCNENQGNRG RINQIILDE FSRKVDLTEN HKILARLPIH TYWTTAYDRL IEKALEEENK IADVKYTVKQ LATTKVKRDA VVYKMHGDVE H PSEAVLIK ...文字列: SGGMKMNPIV ELFIKDFTKE VMEENAAIFA GAGLSMSVGY VSWAKLLEPI AQEIGLDVNK ENDLVSLAQY YCNENQGNRG RINQIILDE FSRKVDLTEN HKILARLPIH TYWTTAYDRL IEKALEEENK IADVKYTVKQ LATTKVKRDA VVYKMHGDVE H PSEAVLIK DDYEKYSIKM DPYIKALSGD LVSKTFLFVG FSFTDPNLDY ILSRVRSAYE RDQRRHYCLI KKEERRPDEL EA DFEYRVR KQELFISDLS RFNIKTIVLN NYNEITEILQ RIENNIKTKT VFLSGSAVEY NHWETEHAEQ FIHQLSKELI RKD FNIVSG FGLGVGSFVI NGVLEELYMN QGTIDDDRLI LRPFPQGKKG EEQWDKYRRD MITRTGVSIF LYGNKIDKGQ VVKA KGVQS EFNISFEQNN YVVPVGATGY IAKDLWNKVN EEFETYYPGA DARMKKLFGE LNNEALSIEE LINTIIEFVE ILSN UniProtKB: NAD(+) hydrolase ThsA |
-分子 #2: (1S,3S,4R,5R,7R,15R,16S,17R)-5-imidazo[2,1-f]purin-3-yl-10,12-bis...
| 分子 | 名称: (1S,3S,4R,5R,7R,15R,16S,17R)-5-imidazo[2,1-f]purin-3-yl-10,12-bis(oxidanyl)-10,12-bis(oxidanylidene)-2,6,9,11,13,18-hexaoxa-10$l^{5},12$l^{5}-diphosphatricyclo[13.2.1.0^{3,7}]octadecane-4,16,17-triol タイプ: ligand / ID: 2 / コピー数: 12 / 式: RK3 |
|---|---|
| 分子量 | 理論値: 565.322 Da |
-分子 #3: ETHENO-NAD
| 分子 | 名称: ETHENO-NAD / タイプ: ligand / ID: 3 / コピー数: 12 / 式: ENA |
|---|---|
| 分子量 | 理論値: 687.447 Da |
| Chemical component information |  ChemComp-ENA: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 濃度 | 1.0 mg/mL | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 45 sec. / 前処理 - 雰囲気: AIR | ||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 平均電子線量: 30.33 e/Å2 |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
|---|---|
| 得られたモデル |  PDB-8btp: |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)