+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8t42 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Model of TTLL6 MTBH1-2 bound to microtubule | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  LIGASE (リガーゼ) / tubulin post-translational modifications / LIGASE (リガーゼ) / tubulin post-translational modifications /  microtubules (微小管) / TTLL microtubules (微小管) / TTLL | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of cilium movement / protein-glutamic acid ligase activity / tubulin-glutamic acid ligase activity / Carboxyterminal post-translational modifications of tubulin / protein polyglutamylation / regulation of cilium beat frequency involved in ciliary motility / 9+0 non-motile cilium / microtubule severing /  合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) / odontoblast differentiation ...positive regulation of cilium movement / protein-glutamic acid ligase activity / tubulin-glutamic acid ligase activity / Carboxyterminal post-translational modifications of tubulin / protein polyglutamylation / regulation of cilium beat frequency involved in ciliary motility / 9+0 non-motile cilium / microtubule severing / 合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) / odontoblast differentiation ...positive regulation of cilium movement / protein-glutamic acid ligase activity / tubulin-glutamic acid ligase activity / Carboxyterminal post-translational modifications of tubulin / protein polyglutamylation / regulation of cilium beat frequency involved in ciliary motility / 9+0 non-motile cilium / microtubule severing /  合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) / odontoblast differentiation / Post-chaperonin tubulin folding pathway / Carboxyterminal post-translational modifications of tubulin / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane / 合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) / odontoblast differentiation / Post-chaperonin tubulin folding pathway / Carboxyterminal post-translational modifications of tubulin / Microtubule-dependent trafficking of connexons from Golgi to the plasma membrane /  Cilium Assembly / cytoskeleton-dependent intracellular transport / Sealing of the nuclear envelope (NE) by ESCRT-III / Cilium Assembly / cytoskeleton-dependent intracellular transport / Sealing of the nuclear envelope (NE) by ESCRT-III /  Intraflagellar transport / Intraflagellar transport /  Gap junction assembly / Formation of tubulin folding intermediates by CCT/TriC / COPI-independent Golgi-to-ER retrograde traffic / natural killer cell mediated cytotoxicity / microtubule bundle formation / Kinesins / Assembly and cell surface presentation of NMDA receptors / GTPase activating protein binding / COPI-dependent Golgi-to-ER retrograde traffic / Gap junction assembly / Formation of tubulin folding intermediates by CCT/TriC / COPI-independent Golgi-to-ER retrograde traffic / natural killer cell mediated cytotoxicity / microtubule bundle formation / Kinesins / Assembly and cell surface presentation of NMDA receptors / GTPase activating protein binding / COPI-dependent Golgi-to-ER retrograde traffic /  細胞結合 / regulation of synapse organization / nuclear envelope lumen / cytoplasmic microtubule / Recycling pathway of L1 / RHOH GTPase cycle / MHC class I protein binding / RHO GTPases activate IQGAPs / spindle assembly / cellular response to interleukin-4 / Hedgehog 'off' state / microtubule-based process / COPI-mediated anterograde transport / Activation of AMPK downstream of NMDARs / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation / 細胞結合 / regulation of synapse organization / nuclear envelope lumen / cytoplasmic microtubule / Recycling pathway of L1 / RHOH GTPase cycle / MHC class I protein binding / RHO GTPases activate IQGAPs / spindle assembly / cellular response to interleukin-4 / Hedgehog 'off' state / microtubule-based process / COPI-mediated anterograde transport / Activation of AMPK downstream of NMDARs / Mitotic Prometaphase / EML4 and NUDC in mitotic spindle formation / Loss of Nlp from mitotic centrosomes / Loss of proteins required for interphase microtubule organization from the centrosome / Recruitment of mitotic centrosome proteins and complexes / Resolution of Sister Chromatid Cohesion / Recruitment of NuMA to mitotic centrosomes / HSP90 chaperone cycle for steroid hormone receptors (SHR) in the presence of ligand / Anchoring of the basal body to the plasma membrane / MHC class II antigen presentation /  tubulin binding / AURKA Activation by TPX2 / ciliary basal body / Translocation of SLC2A4 (GLUT4) to the plasma membrane / RHO GTPases Activate Formins / tubulin binding / AURKA Activation by TPX2 / ciliary basal body / Translocation of SLC2A4 (GLUT4) to the plasma membrane / RHO GTPases Activate Formins /  加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / PKR-mediated signaling / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / PKR-mediated signaling /  繊毛 / structural constituent of cytoskeleton / 繊毛 / structural constituent of cytoskeleton /  紡錘体 / cytoplasmic ribonucleoprotein granule / microtubule cytoskeleton organization / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / The role of GTSE1 in G2/M progression after G2 checkpoint / microtubule cytoskeleton / 紡錘体 / cytoplasmic ribonucleoprotein granule / microtubule cytoskeleton organization / Aggrephagy / HCMV Early Events / Separation of Sister Chromatids / The role of GTSE1 in G2/M progression after G2 checkpoint / microtubule cytoskeleton /  Regulation of PLK1 Activity at G2/M Transition / azurophil granule lumen / Regulation of PLK1 Activity at G2/M Transition / azurophil granule lumen /  double-stranded RNA binding / mitotic cell cycle / double-stranded RNA binding / mitotic cell cycle /  cell body / cell body /  微小管 / Potential therapeutics for SARS / 微小管 / Potential therapeutics for SARS /  細胞骨格 / 細胞骨格 /  脂質ラフト / protein domain specific binding / 脂質ラフト / protein domain specific binding /  細胞分裂 / 細胞分裂 /  GTPase activity / GTPase activity /  ubiquitin protein ligase binding / Neutrophil degranulation / protein-containing complex binding / GTP binding / structural molecule activity / protein-containing complex / extracellular exosome / extracellular region / ubiquitin protein ligase binding / Neutrophil degranulation / protein-containing complex binding / GTP binding / structural molecule activity / protein-containing complex / extracellular exosome / extracellular region /  ATP binding / ATP binding /  metal ion binding / metal ion binding /  細胞核 / 細胞核 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Mus musculus (ハツカネズミ) Mus musculus (ハツカネズミ)  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.6 Å クライオ電子顕微鏡法 / 解像度: 3.6 Å | ||||||
 データ登録者 データ登録者 | Mahalingan, K.K. / Grotjahn, D. / Li, Y. / Lander, G.C. / Zehr, E.A. / Roll-Mecak, A. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nat Chem Biol / 年: 2024 ジャーナル: Nat Chem Biol / 年: 2024タイトル: Structural basis for α-tubulin-specific and modification state-dependent glutamylation. 著者: Kishore K Mahalingan / Danielle A Grotjahn / Yan Li / Gabriel C Lander / Elena A Zehr / Antonina Roll-Mecak /  要旨: Microtubules have spatiotemporally complex posttranslational modification patterns. Tubulin tyrosine ligase-like (TTLL) enzymes introduce the most prevalent modifications on α-tubulin and β-tubulin. ...Microtubules have spatiotemporally complex posttranslational modification patterns. Tubulin tyrosine ligase-like (TTLL) enzymes introduce the most prevalent modifications on α-tubulin and β-tubulin. How TTLLs specialize for specific substrate recognition and ultimately modification-pattern generation is largely unknown. TTLL6, a glutamylase implicated in ciliopathies, preferentially modifies tubulin α-tails in microtubules. Cryo-electron microscopy, kinetic analysis and single-molecule biochemistry reveal an unprecedented quadrivalent recognition that ensures simultaneous readout of microtubule geometry and posttranslational modification status. By binding to a β-tubulin subunit, TTLL6 modifies the α-tail of the longitudinally adjacent tubulin dimer. Spanning two tubulin dimers along and across protofilaments (PFs) ensures fidelity of recognition of both the α-tail and the microtubule. Moreover, TTLL6 reads out and is stimulated by glutamylation of the β-tail of the laterally adjacent tubulin dimer, mediating crosstalk between α-tail and β-tail. This positive feedback loop can generate localized microtubule glutamylation patterns. Our work uncovers general principles that generate tubulin chemical and topographic complexity. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8t42.cif.gz 8t42.cif.gz | 322.6 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8t42.ent.gz pdb8t42.ent.gz | 254.5 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  8t42.json.gz 8t42.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/t4/8t42 https://data.pdbj.org/pub/pdb/validation_reports/t4/8t42 ftp://data.pdbj.org/pub/pdb/validation_reports/t4/8t42 ftp://data.pdbj.org/pub/pdb/validation_reports/t4/8t42 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 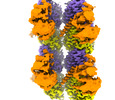 41018MC  8u3zC C: 同じ文献を引用 ( M: このデータのモデリングに利用したマップデータ |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
| 実験データセット #1 | データ参照:  10.6019/EMPIAR-11798 / データの種類: EMPIAR 10.6019/EMPIAR-11798 / データの種類: EMPIAR詳細: Cryo-EM micrographs of human alpha1B/BetaI+BetaIVb microtubules bound to GMPCPP decorated with TTLL6 Metadata reference: 10.6019/EMPIAR-11798 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 3種, 5分子 AFBEN
| #1: タンパク質 | 分子量: 50204.445 Da / 分子数: 2 / 由来タイプ: 天然 / 詳細: a-tubulin from tsA201 cell line / 由来: (天然)   Homo sapiens (ヒト) / Cell: Epithelial-like / 細胞株: tsA201 / 器官: kidney Homo sapiens (ヒト) / Cell: Epithelial-like / 細胞株: tsA201 / 器官: kidney 腎臓 / 組織: kidney 腎臓 / 組織: kidney 腎臓 / 参照: UniProt: P68363 腎臓 / 参照: UniProt: P68363#2: タンパク質 | 分子量: 49717.629 Da / 分子数: 2 / 由来タイプ: 天然 / 由来: (天然)   Homo sapiens (ヒト) / Cell: Epithelial-like / 細胞株: tsA201 / 器官: kidney Homo sapiens (ヒト) / Cell: Epithelial-like / 細胞株: tsA201 / 器官: kidney 腎臓 / 組織: kidney 腎臓 / 組織: kidney 腎臓 / 参照: UniProt: P07437 腎臓 / 参照: UniProt: P07437#3: タンパク質 | | 分子量: 59145.621 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Mus musculus (ハツカネズミ) / 遺伝子: Ttll6 / プラスミド: P7XNH3 / 発現宿主: Mus musculus (ハツカネズミ) / 遺伝子: Ttll6 / プラスミド: P7XNH3 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): Arctic Express DE3 Escherichia coli (大腸菌) / 株 (発現宿主): Arctic Express DE3参照: UniProt: A4Q9E8,  合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) 合成酵素; C-N結合を形成; 酸-D-アミノ酸リガーゼ(ペプチド合成) |
|---|
-非ポリマー , 3種, 8分子 

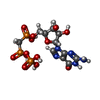


| #4: 化合物 |  グアノシン三リン酸 グアノシン三リン酸#5: 化合物 | ChemComp-MG / #6: 化合物 | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | Y |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: FILAMENT / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 |
| ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.3 MDa / 実験値: YES | ||||||||||||||||||||||||||||||
| 由来(天然) |
| ||||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:   Escherichia coli (大腸菌) / 株: Arctic Express DE3 / プラスミド Escherichia coli (大腸菌) / 株: Arctic Express DE3 / プラスミド : P7XNH3 : P7XNH3 | ||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7 | ||||||||||||||||||||||||||||||
| 緩衝液成分 |
| ||||||||||||||||||||||||||||||
| 試料 | 濃度: 0.1 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES / 詳細: TTLL6 decoration of microtubule was heterogenous : YES / 詳細: TTLL6 decoration of microtubule was heterogenous | ||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R1.2/1.3 | ||||||||||||||||||||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 303 K 詳細: The sample was blotted with Whatman #5 blotting paper on both sides of the grid for 3 s with a blot offset of -1 using a Vitrobot Mark IV (Thermo Fisher Scientific) with a chamber set to 30C ...詳細: The sample was blotted with Whatman #5 blotting paper on both sides of the grid for 3 s with a blot offset of -1 using a Vitrobot Mark IV (Thermo Fisher Scientific) with a chamber set to 30C at 100% humidity and subsequently plunged into liquid ethane. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TALOS ARCTICA |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 36000 X / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1000 nm / Cs Bright-field microscopy / 倍率(公称値): 36000 X / 最大 デフォーカス(公称値): 2000 nm / 最小 デフォーカス(公称値): 1000 nm / Cs : 2.7 mm / アライメント法: COMA FREE : 2.7 mm / アライメント法: COMA FREE |
| 撮影 | 平均露光時間: 9.75 sec. / 電子線照射量: 42 e/Å2 / 検出モード: COUNTING フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 実像数: 2771 |
| 画像スキャン | 動画フレーム数/画像: 39 / 利用したフレーム数/画像: 1-39 |
- 解析
解析
| EMソフトウェア | 名称: PHENIX / バージョン: 1.20.1_4487: / カテゴリ: モデル精密化 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 59044 詳細: Due to highly heterogeneous TTLL6 decoration of microtubules microtubules were manually selected. 59044 overlapping segments with a box size of 568 pixels were extracted every 82 A | ||||||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 392289 / アルゴリズム: FOURIER SPACE / クラス平均像の数: 1 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL / Target criteria: Cross-correlation | ||||||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | 3D fitting-ID: 1
| ||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー






 PDBj
PDBj
































