+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6ctv | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Ternary complex crystal structure of DNA polymerase Beta with a dideoxy terminated primer with CF2, beta, gamma dCTP analogue | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | transcription/dna /  DNA Polymerase Beta / DNA Polymerase Beta /  Conformational Change (コンフォメーション変化) / Conformational Change (コンフォメーション変化) /  enzyme mechanism (酵素反応) / enzyme mechanism (酵素反応) /  LFER (自由エネルギー関係) / transcription-dna complex LFER (自由エネルギー関係) / transcription-dna complex | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Resolution of AP sites via the single-nucleotide replacement pathway / immunoglobulin heavy chain V-D-J recombination / Resolution of AP sites via the multiple-nucleotide patch replacement pathway / Abasic sugar-phosphate removal via the single-nucleotide replacement pathway / APEX1-Independent Resolution of AP Sites via the Single Nucleotide Replacement Pathway /  付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ / homeostasis of number of cells / 5'-deoxyribose-5-phosphate lyase activity / PCNA-Dependent Long Patch Base Excision Repair / POLB-Dependent Long Patch Base Excision Repair ...Resolution of AP sites via the single-nucleotide replacement pathway / immunoglobulin heavy chain V-D-J recombination / Resolution of AP sites via the multiple-nucleotide patch replacement pathway / Abasic sugar-phosphate removal via the single-nucleotide replacement pathway / APEX1-Independent Resolution of AP Sites via the Single Nucleotide Replacement Pathway / 付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ / homeostasis of number of cells / 5'-deoxyribose-5-phosphate lyase activity / PCNA-Dependent Long Patch Base Excision Repair / POLB-Dependent Long Patch Base Excision Repair ...Resolution of AP sites via the single-nucleotide replacement pathway / immunoglobulin heavy chain V-D-J recombination / Resolution of AP sites via the multiple-nucleotide patch replacement pathway / Abasic sugar-phosphate removal via the single-nucleotide replacement pathway / APEX1-Independent Resolution of AP Sites via the Single Nucleotide Replacement Pathway /  付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ / homeostasis of number of cells / 5'-deoxyribose-5-phosphate lyase activity / PCNA-Dependent Long Patch Base Excision Repair / POLB-Dependent Long Patch Base Excision Repair / pyrimidine dimer repair / response to hyperoxia / somatic hypermutation of immunoglobulin genes / lymph node development / salivary gland morphogenesis / class I DNA-(apurinic or apyrimidinic site) endonuclease activity / 付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ / homeostasis of number of cells / 5'-deoxyribose-5-phosphate lyase activity / PCNA-Dependent Long Patch Base Excision Repair / POLB-Dependent Long Patch Base Excision Repair / pyrimidine dimer repair / response to hyperoxia / somatic hypermutation of immunoglobulin genes / lymph node development / salivary gland morphogenesis / class I DNA-(apurinic or apyrimidinic site) endonuclease activity /  base-excision repair, gap-filling / spleen development / DNA-(apurinic or apyrimidinic site) endonuclease activity / base-excision repair, gap-filling / spleen development / DNA-(apurinic or apyrimidinic site) endonuclease activity /  DNA-(apurinic or apyrimidinic site) lyase / spindle microtubule / response to gamma radiation / DNA-(apurinic or apyrimidinic site) lyase / spindle microtubule / response to gamma radiation /  塩基除去修復 / DNA-templated DNA replication / double-strand break repair via nonhomologous end joining / intrinsic apoptotic signaling pathway in response to DNA damage / 塩基除去修復 / DNA-templated DNA replication / double-strand break repair via nonhomologous end joining / intrinsic apoptotic signaling pathway in response to DNA damage /  microtubule binding / neuron apoptotic process / response to ethanol / in utero embryonic development / microtubule binding / neuron apoptotic process / response to ethanol / in utero embryonic development /  微小管 / damaged DNA binding / 微小管 / damaged DNA binding /  DNAポリメラーゼ / DNAポリメラーゼ /  DNA-directed DNA polymerase activity / DNA-directed DNA polymerase activity /  lyase activity / Ub-specific processing proteases / lyase activity / Ub-specific processing proteases /  炎症 / 炎症 /  DNA修復 / DNA damage response / DNA修復 / DNA damage response /  enzyme binding / protein-containing complex / enzyme binding / protein-containing complex /  核質 / 核質 /  metal ion binding / metal ion binding /  細胞核 / 細胞核 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  分子置換 / 解像度: 2.02 Å 分子置換 / 解像度: 2.02 Å | ||||||
 データ登録者 データ登録者 | Batra, V.K. / Wilson, S.H. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2018 ジャーナル: Biochemistry / 年: 2018タイトル: Mapping Functional Substrate-Enzyme Interactions in the pol beta Active Site through Chemical Biology: Structural Responses to Acidity Modification of Incoming dNTPs. 著者: Batra, V.K. / Oertell, K. / Beard, W.A. / Kashemirov, B.A. / McKenna, C.E. / Goodman, M.F. / Wilson, S.H. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
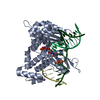
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6ctv.cif.gz 6ctv.cif.gz | 116 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6ctv.ent.gz pdb6ctv.ent.gz | 80.7 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6ctv.json.gz 6ctv.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/ct/6ctv https://data.pdbj.org/pub/pdb/validation_reports/ct/6ctv ftp://data.pdbj.org/pub/pdb/validation_reports/ct/6ctv ftp://data.pdbj.org/pub/pdb/validation_reports/ct/6ctv | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  6belC  6bemC  6cr3C  6cr4C  6cr5C  6cr6C  6cr7C  6cr8C  6cr9C  6crbC  6crcC  6ctiC  6ctjC  6ctkC  6ctlC  6ctmC  6ctnC  6ctoC  6ctpC  6ctqC  6ctrC  6cttC  6ctuC  6ctwC  6ctxC  6g2qC  2fmsS S: 精密化の開始モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||
| 単位格子 |
|
- 要素
要素
-DNA鎖 , 3種, 3分子 TPD
| #1: DNA鎖 | 分子量: 4844.144 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|---|
| #2: DNA鎖 | 分子量: 3069.029 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| #3: DNA鎖 | 分子量: 1536.035 Da / 分子数: 1 / 由来タイプ: 合成 / 由来: (合成)   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-タンパク質 , 1種, 1分子 A
| #4: タンパク質 |  分子量: 38283.750 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: POLB / プラスミド: pwl-11 / 発現宿主: Homo sapiens (ヒト) / 遺伝子: POLB / プラスミド: pwl-11 / 発現宿主:   Escherichia coli (大腸菌) / 株 (発現宿主): Tap56 Escherichia coli (大腸菌) / 株 (発現宿主): Tap56参照: UniProt: P06746,  DNAポリメラーゼ, DNAポリメラーゼ,  付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ 付加脱離酵素(リアーゼ); 炭素-酸素リアーゼ類; その他の炭素-酸素リアーゼ |
|---|
-非ポリマー , 6種, 396分子 








| #5: 化合物 | | #6: 化合物 | #7: 化合物 | ChemComp-CL / |  塩化物 塩化物#8: 化合物 | ChemComp-FFJ / | #9: 化合物 | ChemComp-DC / |  デオキシシチジン一リン酸 デオキシシチジン一リン酸#10: 水 | ChemComp-HOH / |  水 水 |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.27 Å3/Da / 溶媒含有率: 45.79 % / Mosaicity: 1.776 ° |
|---|---|
結晶化 | 温度: 291 K / 手法: 蒸気拡散法, シッティングドロップ法 / 詳細: 16-18% PEG 3350 / PH範囲: 7.5, 50 mM Imidazole, 350 mM Sodium Acetate |
-データ収集
| 回折 | 平均測定温度: 100 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 放射光源 | 由来:  回転陽極 / タイプ: RIGAKU MICROMAX-007 / 波長: 1.5418 Å 回転陽極 / タイプ: RIGAKU MICROMAX-007 / 波長: 1.5418 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 検出器 | タイプ: DECTRIS PILATUS3 X CdTe 1M / 検出器: PIXEL / 日付: 2017年5月4日 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 放射波長 | 波長 : 1.5418 Å / 相対比: 1 : 1.5418 Å / 相対比: 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 | 解像度: 2.02→50 Å / Num. obs: 27204 / % possible obs: 98.9 % / 冗長度: 3.3 % / Rmerge(I) obs: 0.069 / Rpim(I) all: 0.043 / Rrim(I) all: 0.081 / Χ2: 0.974 / Net I/σ(I): 11.9 / Num. measured all: 91010 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 反射 シェル | Diffraction-ID: 1
|
- 解析
解析
| ソフトウェア |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 2FMS 解像度: 2.02→23.616 Å / SU ML: 0.21 / 交差検証法: THROUGHOUT / σ(F): 1.33 / 位相誤差: 23.34
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso max: 87.25 Å2 / Biso mean: 31.4264 Å2 / Biso min: 15.5 Å2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: final / 解像度: 2.02→23.616 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | Refine-ID: X-RAY DIFFRACTION / Rfactor Rfree error: 0 / Total num. of bins used: 14
|
 ムービー
ムービー コントローラー
コントローラー






















 PDBj
PDBj













































