| 登録情報 | データベース: PDB / ID: 2mo0
|
|---|
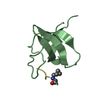
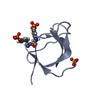
| タイトル | Backbone 1H, 13C, and 15N Chemical Shift Assignments for cold shock protein, TaCsp |
|---|
 要素 要素 | Cold-shock DNA-binding domain protein |
|---|
 キーワード キーワード |  DNA BINDING PROTEIN (DNA結合タンパク質) / DNA BINDING PROTEIN (DNA結合タンパク質) /  cold shock protein / cold shock protein /  thermus aquaticus (サーマス・アクアティカス) / thermus aquaticus (サーマス・アクアティカス) /  protein binding (タンパク質) / protein binding (タンパク質) /  protein stability (フォールディング) protein stability (フォールディング) |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 |
|---|
| 生物種 |    Thermus aquaticus (サーマス・アクアティカス) Thermus aquaticus (サーマス・アクアティカス) |
|---|
| 手法 |  溶液NMR / distance geometry 溶液NMR / distance geometry |
|---|
| Model details | lowest energy, model1 |
|---|
 データ登録者 データ登録者 | Jin, B. / Jeong, K.W. / Kim, Y. |
|---|
 引用 引用 |  ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2014 ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2014
タイトル: Structure and flexibility of the thermophilic cold-shock protein of Thermus aquaticus.
著者: Jin, B. / Jeong, K.W. / Kim, Y. |
|---|
| 履歴 | | 登録 | 2014年4月17日 | 登録サイト: BMRB / 処理サイト: PDBJ |
|---|
| 改定 1.0 | 2014年8月20日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2020年9月9日 | Group: Data collection / Derived calculations / Structure summary
カテゴリ: pdbx_nmr_spectrometer / pdbx_struct_assembly_prop ...pdbx_nmr_spectrometer / pdbx_struct_assembly_prop / pdbx_struct_oper_list / struct_keywords
Item: _pdbx_nmr_spectrometer.model / _pdbx_struct_oper_list.symmetry_operation / _struct_keywords.text |
|---|
| 改定 1.2 | 2022年8月24日 | Group: Database references / カテゴリ: citation / database_2
Item: _citation.journal_volume / _citation.page_first ..._citation.journal_volume / _citation.page_first / _citation.page_last / _citation.title / _database_2.pdbx_DOI / _database_2.pdbx_database_accession |
|---|
| 改定 1.3 | 2023年6月14日 | Group: Other / カテゴリ: pdbx_database_status / Item: _pdbx_database_status.status_code_nmr_data |
|---|
| 改定 1.4 | 2024年5月15日 | Group: Data collection / Database references / カテゴリ: chem_comp_atom / chem_comp_bond / database_2 / Item: _database_2.pdbx_DOI |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード DNA BINDING PROTEIN (DNA結合タンパク質) /
DNA BINDING PROTEIN (DNA結合タンパク質) /  cold shock protein /
cold shock protein /  thermus aquaticus (サーマス・アクアティカス) /
thermus aquaticus (サーマス・アクアティカス) /  protein binding (タンパク質) /
protein binding (タンパク質) /  protein stability (フォールディング)
protein stability (フォールディング) 機能・相同性情報
機能・相同性情報

 Thermus aquaticus (サーマス・アクアティカス)
Thermus aquaticus (サーマス・アクアティカス) 溶液NMR / distance geometry
溶液NMR / distance geometry  データ登録者
データ登録者 引用
引用 ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2014
ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2014 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 2mo0.cif.gz
2mo0.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb2mo0.ent.gz
pdb2mo0.ent.gz PDB形式
PDB形式 2mo0.json.gz
2mo0.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/mo/2mo0
https://data.pdbj.org/pub/pdb/validation_reports/mo/2mo0 ftp://data.pdbj.org/pub/pdb/validation_reports/mo/2mo0
ftp://data.pdbj.org/pub/pdb/validation_reports/mo/2mo0 リンク
リンク 集合体
集合体
 要素
要素

 Thermus aquaticus (サーマス・アクアティカス)
Thermus aquaticus (サーマス・アクアティカス)
 Escherichia coli (大腸菌) / 参照: UniProt: B7ABH3
Escherichia coli (大腸菌) / 参照: UniProt: B7ABH3 溶液NMR
溶液NMR 試料調製
試料調製 解析
解析 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj