+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2aad | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | THE ROLE OF HISTIDINE-40 IN RIBONUCLEASE T1 CATALYSIS: THREE-DIMENSIONAL STRUCTURES OF THE PARTIALLY ACTIVE HIS40LYS MUTANT | ||||||
 要素 要素 | RIBONUCLEASE T1 ISOZYME | ||||||
 キーワード キーワード | HYDROLASE(ENDORIBONUCLEASE) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報hyphal tip /  ribonuclease T1 activity / ribonuclease T1 activity /  ribonuclease T1 / cell septum / ribonuclease T1 / cell septum /  endonuclease activity / endonuclease activity /  lyase activity / lyase activity /  RNA binding RNA binding類似検索 - 分子機能 | ||||||
| 生物種 |   Aspergillus oryzae (米麹菌) Aspergillus oryzae (米麹菌) | ||||||
| 手法 |  X線回折 / 解像度: 2 Å X線回折 / 解像度: 2 Å | ||||||
 データ登録者 データ登録者 | Zegers, I. / Verhelst, P. / Choe, C.W. / Steyaert, J. / Heinemann, U. / Wyns, L. / Saenger, W. | ||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 1992 ジャーナル: Biochemistry / 年: 1992タイトル: Role of histidine-40 in ribonuclease T1 catalysis: three-dimensionalstructures of the partially active His40Lys mutant. 著者: Zegers, I. / Verhelst, P. / Choe, H.W. / Steyaert, J. / Heinemann, U. / Saenger, W. / Wyns, L. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2aad.cif.gz 2aad.cif.gz | 53.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2aad.ent.gz pdb2aad.ent.gz | 41.2 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2aad.json.gz 2aad.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/aa/2aad https://data.pdbj.org/pub/pdb/validation_reports/aa/2aad ftp://data.pdbj.org/pub/pdb/validation_reports/aa/2aad ftp://data.pdbj.org/pub/pdb/validation_reports/aa/2aad | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 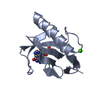
| ||||||||
| 2 | 
| ||||||||
| 単位格子 |
| ||||||||
| Atom site foot note | 1: RESIDUES PRO 39 AND PRO 55 OF BOTH CHAINS ARE CIS PROLINES. |
- 要素
要素
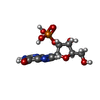
| #1: タンパク質 | 分子量: 11085.728 Da / 分子数: 2 / 由来タイプ: 組換発現 / 由来: (組換発現)   Aspergillus oryzae (米麹菌) / 参照: UniProt: P00651, EC: 3.1.27.3 Aspergillus oryzae (米麹菌) / 参照: UniProt: P00651, EC: 3.1.27.3#2: 化合物 | #3: 化合物 |  グアニル酸 グアニル酸#4: 水 | ChemComp-HOH / |  水 水構成要素の詳細 | THE PROTEIN USED IN THIS STUDY IS THE ISOZYME OF RIBONUCLEASE T1 WHERE A LYSINE RESIDUE REPLACES ...THE PROTEIN USED IN THIS STUDY IS THE ISOZYME OF RIBONUCLEA | |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 X線回折 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.15 Å3/Da / 溶媒含有率: 42.7 % | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
結晶化 | *PLUS pH: 4.2 / 手法: 蒸気拡散法, シッティングドロップ法 | ||||||||||||||||||||||||||||||
| 溶液の組成 | *PLUS
|
-データ収集
| 反射 | *PLUS 最高解像度: 2 Å / Rmerge(I) obs: 0.093 |
|---|---|
| 反射 シェル | *PLUS 最高解像度: 2 Å / 最低解像度: 2.7 Å / % possible obs: 77 % |
- 解析
解析
| ソフトウェア | 名称: PROLSQ / 分類: 精密化 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 解像度: 2→10 Å / σ(F): 2 /
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2→10 Å
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ソフトウェア | *PLUS 名称: PROLSQ / 分類: refinement | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 | *PLUS 最高解像度: 2 Å / 最低解像度: 10 Å / Num. reflection obs: 5986 / σ(F): 2 / Rfactor obs: 0.16 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | *PLUS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 | *PLUS タイプ: p_angle_d / Dev ideal: 0.056 |
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj