+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | human KCNQ2-CaM-Ebio1-S1 complex in the presence of PIP2 | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Potassium voltage-gated channel subfamily KQT member 2 / Ebio1-S1 /  MEMBRANE PROTEIN (膜タンパク質) MEMBRANE PROTEIN (膜タンパク質) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報axon initial segment / Voltage gated Potassium channels /  ランヴィエの絞輪 / Interaction between L1 and Ankyrins / ランヴィエの絞輪 / Interaction between L1 and Ankyrins /  CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde ...axon initial segment / Voltage gated Potassium channels / CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde ...axon initial segment / Voltage gated Potassium channels /  ランヴィエの絞輪 / Interaction between L1 and Ankyrins / ランヴィエの絞輪 / Interaction between L1 and Ankyrins /  CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / Activation of Ca-permeable Kainate Receptor / Loss of phosphorylation of MECP2 at T308 / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation / negative regulation of high voltage-gated calcium channel activity / CAM型光合成 / Cam-PDE 1 activation / Sodium/Calcium exchangers / Calmodulin induced events / Reduction of cytosolic Ca++ levels / CREB1 phosphorylation through the activation of CaMKII/CaMKK/CaMKIV cascasde / Activation of Ca-permeable Kainate Receptor / Loss of phosphorylation of MECP2 at T308 / CREB1 phosphorylation through the activation of Adenylate Cyclase / PKA activation / negative regulation of high voltage-gated calcium channel activity /  ankyrin binding / CaMK IV-mediated phosphorylation of CREB / Glycogen breakdown (glycogenolysis) / organelle localization by membrane tethering / negative regulation of calcium ion export across plasma membrane / Activation of RAC1 downstream of NMDARs / mitochondrion-endoplasmic reticulum membrane tethering / CLEC7A (Dectin-1) induces NFAT activation / regulation of cardiac muscle cell action potential / autophagosome membrane docking / positive regulation of ryanodine-sensitive calcium-release channel activity / Negative regulation of NMDA receptor-mediated neuronal transmission / regulation of cell communication by electrical coupling involved in cardiac conduction / negative regulation of peptidyl-threonine phosphorylation / Unblocking of NMDA receptors, glutamate binding and activation / Synthesis of IP3 and IP4 in the cytosol / Phase 0 - rapid depolarisation / protein phosphatase activator activity / RHO GTPases activate PAKs / ankyrin binding / CaMK IV-mediated phosphorylation of CREB / Glycogen breakdown (glycogenolysis) / organelle localization by membrane tethering / negative regulation of calcium ion export across plasma membrane / Activation of RAC1 downstream of NMDARs / mitochondrion-endoplasmic reticulum membrane tethering / CLEC7A (Dectin-1) induces NFAT activation / regulation of cardiac muscle cell action potential / autophagosome membrane docking / positive regulation of ryanodine-sensitive calcium-release channel activity / Negative regulation of NMDA receptor-mediated neuronal transmission / regulation of cell communication by electrical coupling involved in cardiac conduction / negative regulation of peptidyl-threonine phosphorylation / Unblocking of NMDA receptors, glutamate binding and activation / Synthesis of IP3 and IP4 in the cytosol / Phase 0 - rapid depolarisation / protein phosphatase activator activity / RHO GTPases activate PAKs /  voltage-gated potassium channel activity / positive regulation of cyclic-nucleotide phosphodiesterase activity / positive regulation of phosphoprotein phosphatase activity / Ion transport by P-type ATPases / voltage-gated potassium channel activity / positive regulation of cyclic-nucleotide phosphodiesterase activity / positive regulation of phosphoprotein phosphatase activity / Ion transport by P-type ATPases /  長期増強 / Uptake and function of anthrax toxins / Calcineurin activates NFAT / Regulation of MECP2 expression and activity / 長期増強 / Uptake and function of anthrax toxins / Calcineurin activates NFAT / Regulation of MECP2 expression and activity /  catalytic complex / DARPP-32 events / detection of calcium ion / negative regulation of ryanodine-sensitive calcium-release channel activity / Smooth Muscle Contraction / RHO GTPases activate IQGAPs / regulation of cardiac muscle contraction / calcium channel inhibitor activity / cellular response to interferon-beta / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion / catalytic complex / DARPP-32 events / detection of calcium ion / negative regulation of ryanodine-sensitive calcium-release channel activity / Smooth Muscle Contraction / RHO GTPases activate IQGAPs / regulation of cardiac muscle contraction / calcium channel inhibitor activity / cellular response to interferon-beta / regulation of cardiac muscle contraction by regulation of the release of sequestered calcium ion /  Protein methylation / Protein methylation /  voltage-gated potassium channel complex / eNOS activation / Activation of AMPK downstream of NMDARs / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / regulation of calcium-mediated signaling / positive regulation of protein dephosphorylation / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation / voltage-gated potassium channel complex / eNOS activation / Activation of AMPK downstream of NMDARs / regulation of release of sequestered calcium ion into cytosol by sarcoplasmic reticulum / regulation of calcium-mediated signaling / positive regulation of protein dephosphorylation / Tetrahydrobiopterin (BH4) synthesis, recycling, salvage and regulation /  titin binding / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity / positive regulation of protein autophosphorylation / potassium ion transmembrane transport / sperm midpiece / titin binding / Ion homeostasis / regulation of ryanodine-sensitive calcium-release channel activity / positive regulation of protein autophosphorylation / potassium ion transmembrane transport / sperm midpiece /  calcium channel complex / substantia nigra development / adenylate cyclase activator activity / Ras activation upon Ca2+ influx through NMDA receptor / calcium channel complex / substantia nigra development / adenylate cyclase activator activity / Ras activation upon Ca2+ influx through NMDA receptor /  regulation of heart rate / protein serine/threonine kinase activator activity / regulation of heart rate / protein serine/threonine kinase activator activity /  sarcomere / FCERI mediated Ca+2 mobilization / FCGR3A-mediated IL10 synthesis / VEGFR2 mediated vascular permeability / positive regulation of peptidyl-threonine phosphorylation / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / VEGFR2 mediated cell proliferation / sarcomere / FCERI mediated Ca+2 mobilization / FCGR3A-mediated IL10 synthesis / VEGFR2 mediated vascular permeability / positive regulation of peptidyl-threonine phosphorylation / Antigen activates B Cell Receptor (BCR) leading to generation of second messengers / VEGFR2 mediated cell proliferation /  regulation of cytokinesis / Translocation of SLC2A4 (GLUT4) to the plasma membrane / spindle microtubule / RAF activation / positive regulation of receptor signaling pathway via JAK-STAT / positive regulation of protein serine/threonine kinase activity / Transcriptional activation of mitochondrial biogenesis / Stimuli-sensing channels / regulation of cytokinesis / Translocation of SLC2A4 (GLUT4) to the plasma membrane / spindle microtubule / RAF activation / positive regulation of receptor signaling pathway via JAK-STAT / positive regulation of protein serine/threonine kinase activity / Transcriptional activation of mitochondrial biogenesis / Stimuli-sensing channels /  紡錘体 / cellular response to type II interferon / response to calcium ion / RAS processing / calcium-dependent protein binding / Inactivation, recovery and regulation of the phototransduction cascade / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / G2/M transition of mitotic cell cycle / Signaling by BRAF and RAF1 fusions / Platelet degranulation 紡錘体 / cellular response to type II interferon / response to calcium ion / RAS processing / calcium-dependent protein binding / Inactivation, recovery and regulation of the phototransduction cascade / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / G2/M transition of mitotic cell cycle / Signaling by BRAF and RAF1 fusions / Platelet degranulation 類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.0 Å クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Ma D / Guo J | |||||||||
| 資金援助 |  中国, 2件 中国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Chem Biol / 年: 2024 ジャーナル: Nat Chem Biol / 年: 2024タイトル: A small-molecule activation mechanism that directly opens the KCNQ2 channel. 著者: Shaoying Zhang / Demin Ma / Kun Wang / Ya Li / Zhenni Yang / Xiaoxiao Li / Junnan Li / Jiangnan He / Lianghe Mei / Yangliang Ye / Zongsheng Chen / Juwen Shen / Panpan Hou / Jiangtao Guo / ...著者: Shaoying Zhang / Demin Ma / Kun Wang / Ya Li / Zhenni Yang / Xiaoxiao Li / Junnan Li / Jiangnan He / Lianghe Mei / Yangliang Ye / Zongsheng Chen / Juwen Shen / Panpan Hou / Jiangtao Guo / Qiansen Zhang / Huaiyu Yang /  要旨: Pharmacological activation of voltage-gated ion channels by ligands serves as the basis for therapy and mainly involves a classic gating mechanism that augments the native voltage-dependent open ...Pharmacological activation of voltage-gated ion channels by ligands serves as the basis for therapy and mainly involves a classic gating mechanism that augments the native voltage-dependent open probability. Through structure-based virtual screening, we identified a new scaffold compound, Ebio1, serving as a potent and subtype-selective activator for the voltage-gated potassium channel KCNQ2 and featuring a new activation mechanism. Single-channel patch-clamp, cryogenic-electron microscopy and molecular dynamic simulations, along with chemical derivatives, reveal that Ebio1 engages the KCNQ2 activation by generating an extended channel gate with a larger conductance at the saturating voltage (+50 mV). This mechanism is different from the previously observed activation mechanism of ligands on voltage-gated ion channels. Ebio1 caused S6 helices from residues S303 and F305 to perform a twist-to-open movement, which was sufficient to open the KCNQ2 gate. Overall, our findings provide mechanistic insights into the activation of KCNQ2 channel by Ebio1 and lend support for KCNQ-related drug development. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_38041.map.gz emd_38041.map.gz | 48.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-38041-v30.xml emd-38041-v30.xml emd-38041.xml emd-38041.xml | 15.8 KB 15.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_38041.png emd_38041.png | 44.8 KB | ||
| Filedesc metadata |  emd-38041.cif.gz emd-38041.cif.gz | 5.9 KB | ||
| その他 |  emd_38041_half_map_1.map.gz emd_38041_half_map_1.map.gz emd_38041_half_map_2.map.gz emd_38041_half_map_2.map.gz | 37.1 MB 37.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-38041 http://ftp.pdbj.org/pub/emdb/structures/EMD-38041 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38041 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-38041 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8x43MC  8ijkC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_38041.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_38041.map.gz / 形式: CCP4 / 大きさ: 52.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.93 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_38041_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
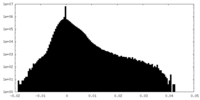
| 投影像・断面図 |
| ||||||||||||
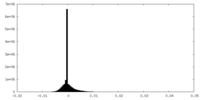
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_38041_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
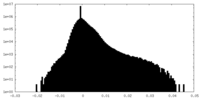
| 投影像・断面図 |
| ||||||||||||
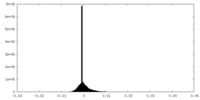
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human KCNQ2-CaM-Ebio1-S1 complex in the presence of PIP2
| 全体 | 名称: human KCNQ2-CaM-Ebio1-S1 complex in the presence of PIP2 |
|---|---|
| 要素 |
|
-超分子 #1: human KCNQ2-CaM-Ebio1-S1 complex in the presence of PIP2
| 超分子 | 名称: human KCNQ2-CaM-Ebio1-S1 complex in the presence of PIP2 タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Potassium voltage-gated channel subfamily KQT member 2
| 分子 | 名称: Potassium voltage-gated channel subfamily KQT member 2 タイプ: protein_or_peptide / ID: 1 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 73.627812 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MAGKPPKRNA FYRKLQNFLY NVLERPRGWA FIYHAYVFLL VFSCLVLSVF STIKEYEKSS EGALYILEIV TIVVFGVEYF VRIWAAGCC CRYRGWRGRL KFARKPFCVI DIMVLIASIA VLAAGSQGNV FATSALRSLR FLQILRMIRM DRRGGTWKLL G SVVYAHSK ...文字列: MAGKPPKRNA FYRKLQNFLY NVLERPRGWA FIYHAYVFLL VFSCLVLSVF STIKEYEKSS EGALYILEIV TIVVFGVEYF VRIWAAGCC CRYRGWRGRL KFARKPFCVI DIMVLIASIA VLAAGSQGNV FATSALRSLR FLQILRMIRM DRRGGTWKLL G SVVYAHSK ELVTAWYIGF LCLILASFLV YLAEKGENDH FDTYADALWW GLITLTTIGY GDKYPQTWNG RLLAATFTLI GV SFFALPA GILGSGFALK VQEQHRQKHF EKRRNPAAGL IQSAWRFYAT NLSRTDLHST WQYYERTVTV PMYSSQTQTY GAS RLIPPL NQLELLRNLK SKSGLAFRKD PPPEPSPSKG SPCRGPLCGC CPGRSSQKVS LKDRVFSSPR GVAAKGKGSP QAQT VRRSP SADQSLEDSP SKVPKSWSFG DRSRARQAFR IKGAASRQNS EEASLPGEDI VDDKSCPCEF VTEDLTPGLK VSIRA VCVM RFLVSKRKFK ESLRPYDVMD VIEQYSAGHL DMLSRIKSLQ SRVDQIVGRG PAITDKDRTK GPAEAELPED PSMMGR LGK VEKQVLSMEK KLDFLVNIYM QRMGIPPTET EAYFGAKEPE PAPPYHSPED SREHVDRHGC IVKIVRSSSS TGQKNFS VE GGSSGGWSHP QFEK UniProtKB: Potassium voltage-gated channel subfamily KQT member 2 |
-分子 #2: Calmodulin-1
| 分子 | 名称: Calmodulin-1 / タイプ: protein_or_peptide / ID: 2 / コピー数: 4 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 16.852545 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MADQLTEEQI AEFKEAFSLF DKDGDGTITT KELGTVMRSL GQNPTEAELQ DMINEVDADG NGTIDFPEFL TMMARKMKDT DSEEEIREA FRVFDKDGNG YISAAELRHV MTNLGEKLTD EEVDEMIREA DIDGDGQVNY EEFVQMMTAK UniProtKB:  Calmodulin-1 Calmodulin-1 |
-分子 #3: N-(4-azanyl-1,2-dihydroacenaphthylen-5-yl)-4-fluoranyl-benzamide
| 分子 | 名称: N-(4-azanyl-1,2-dihydroacenaphthylen-5-yl)-4-fluoranyl-benzamide タイプ: ligand / ID: 3 / コピー数: 4 / 式: 7Q0 |
|---|---|
| 分子量 | 理論値: 306.334 Da |
| Chemical component information | 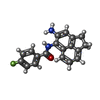 ChemComp-7Q0: |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.8 µm Bright-field microscopy / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.8 µm |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 平均電子線量: 52.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.0 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 151312 |
 ムービー
ムービー コントローラー
コントローラー


























 Z
Z Y
Y X
X