+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM characterization of BrxL -- a unique AAA+ phage restriction Factor. | |||||||||
 マップデータ マップデータ | combined 1.12 pixel data collected at Hutch with 1.16 pixel data from UW, ie down sampled from 1.12 to 1.16 | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-dependent peptidase activity / protein catabolic process / serine-type endopeptidase activity /  タンパク質分解 / タンパク質分解 /  ATP binding ATP binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Acinetobacter (アシネトバクター) / Acinetobacter (アシネトバクター) /  Acinetobacter sp. NEB 394 (バクテリア) Acinetobacter sp. NEB 394 (バクテリア) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.6 Å クライオ電子顕微鏡法 / 解像度: 3.6 Å | |||||||||
 データ登録者 データ登録者 | Shen BW / Stoddard BL | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2023 ジャーナル: Nucleic Acids Res / 年: 2023タイトル: Structure, substrate binding and activity of a unique AAA+ protein: the BrxL phage restriction factor. 著者: Betty W Shen / Lindsey A Doyle / Rachel Werther / Abigail A Westburg / Daniel P Bies / Stephanie I Walter / Yvette A Luyten / Richard D Morgan / Barry L Stoddard / Brett K Kaiser /  要旨: Bacteriophage exclusion ('BREX') systems are multi-protein complexes encoded by a variety of bacteria and archaea that restrict phage by an unknown mechanism. One BREX factor, termed BrxL, has been ...Bacteriophage exclusion ('BREX') systems are multi-protein complexes encoded by a variety of bacteria and archaea that restrict phage by an unknown mechanism. One BREX factor, termed BrxL, has been noted to display sequence similarity to various AAA+ protein factors including Lon protease. In this study we describe multiple CryoEM structures of BrxL that demonstrate it to be a chambered, ATP-dependent DNA binding protein. The largest BrxL assemblage corresponds to a dimer of heptamers in the absence of bound DNA, versus a dimer of hexamers when DNA is bound in its central pore. The protein displays DNA-dependent ATPase activity, and ATP binding promotes assembly of the complex on DNA. Point mutations within several regions of the protein-DNA complex alter one or more in vitro behaviors and activities, including ATPase activity and ATP-dependent association with DNA. However, only the disruption of the ATPase active site fully eliminates phage restriction, indicating that other mutations can still complement BrxL function within the context of an otherwise intact BREX system. BrxL displays significant structural homology to MCM subunits (the replicative helicase in archaea and eukaryotes), implying that it and other BREX factors may collaborate to disrupt initiation of phage DNA replication. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_28244.map.gz emd_28244.map.gz | 114.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-28244-v30.xml emd-28244-v30.xml emd-28244.xml emd-28244.xml | 17.8 KB 17.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_28244.png emd_28244.png | 148.3 KB | ||
| その他 |  emd_28244_half_map_1.map.gz emd_28244_half_map_1.map.gz emd_28244_half_map_2.map.gz emd_28244_half_map_2.map.gz | 213.4 MB 213.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-28244 http://ftp.pdbj.org/pub/emdb/structures/EMD-28244 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28244 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-28244 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_28244.map.gz / 形式: CCP4 / 大きさ: 229.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_28244.map.gz / 形式: CCP4 / 大きさ: 229.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | combined 1.12 pixel data collected at Hutch with 1.16 pixel data from UW, ie down sampled from 1.12 to 1.16 | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.16 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
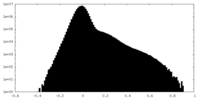
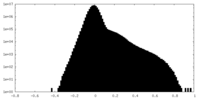
-ハーフマップ: half map A
| ファイル | emd_28244_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
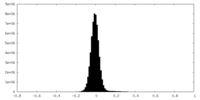
-ハーフマップ: half map B
| ファイル | emd_28244_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : dimer of heptamer complex of BrxL
| 全体 | 名称: dimer of heptamer complex of BrxL |
|---|---|
| 要素 |
|
-超分子 #1: dimer of heptamer complex of BrxL
| 超分子 | 名称: dimer of heptamer complex of BrxL / タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Acinetobacter (アシネトバクター) Acinetobacter (アシネトバクター) |
| 分子量 | 理論値: 1.05 MDa |
-分子 #1: Protease Lon-related BREX system protein BrxL
| 分子 | 名称: Protease Lon-related BREX system protein BrxL / タイプ: protein_or_peptide / ID: 1 / コピー数: 14 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Acinetobacter sp. NEB 394 (バクテリア) Acinetobacter sp. NEB 394 (バクテリア) |
| 分子量 | 理論値: 75.703539 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MESANDKELD QLLNEHFAGR VVRKDLTKLI KEGANVPVYV LEYLLGMYCA SDDPEIIEQG LRNVKTVLAE NYVRPDEAEK VKSLVRERG SYKVIDRVTV KLNERKDKYE ASFSNLGIKD AEISAGIVKE YEKLLVGGIW VIATLSYYFE EGQTSSPFGV S LLKPIQMP ...文字列: MESANDKELD QLLNEHFAGR VVRKDLTKLI KEGANVPVYV LEYLLGMYCA SDDPEIIEQG LRNVKTVLAE NYVRPDEAEK VKSLVRERG SYKVIDRVTV KLNERKDKYE ASFSNLGIKD AEISAGIVKE YEKLLVGGIW VIATLSYYFE EGQTSSPFGV S LLKPIQMP NMNMDELFSG RAALSTDQWR ESLIRSIGME PASLKEDVQW HLLARMVPFV ENNYNVCELG PRGTGKSHIY KE CSPNSIL VSGGQTTVAN LFYNMSSRRI GLVGLWDVVA FDEVAGISFK DKDGVQIMKD YMASGSFARG REQMEASASM VFV GNINQS VESLVKTSHL LAPFPEAMID SAFFDRFHAY IPGWEIPKMR PEFFTNRYGL IVDYLAEFFR EMRKRSFADS IEKY FKLGN NLNQRDVIAV RKTVSGLMKL LYPHGQFNKE DVRQCLEYAL QVRRRVKEQL KKIGGMEFYD VHFSYIDNDT LEEHF VSVK EQGGGGLIPE GPAKPGFLYT IGLSNKGMPG LYRLELQVTK GSGKLATSGL WNSSSAKEQV KIAFDYFKAN ASRISG GSK VMEHDFHLHV VELQNTGPLS HLALPSLVAF ASGLLGRSVQ SQMVVLGDMS LGGSVTPVES IAECLQVAFD AGAKKVA LP MSSAADIPTI PVELFTKFQT SFYADPVDAV FKGLGVD |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.6 mg/mL |
|---|---|
| 緩衝液 | pH: 8 / 詳細: 20 mM TrisHCl, 150 mM NaCl |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 15 sec. / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 298 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | This sample was mono-dispersed |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 照射モード: OTHER / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 5.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 38000 Bright-field microscopy / Cs: 2.7 mm / 最大 デフォーカス(公称値): 5.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 38000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: DIRECT ELECTRON DE-10 (5k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 2 / 実像数: 3000 / 平均露光時間: 2.0 sec. / 平均電子線量: 50.0 e/Å2 詳細: 2980 movies at 1.12 pixel was extracted at box size of 406 pix, fourier cropped to box size of 392 pix and combined with 100 movies collected at 1.16 pix size |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 96079 |
|---|---|
| 初期 角度割当 | タイプ: OTHER / ソフトウェア - 名称: cryoSPARC (ver. 3.3.2) |
| 最終 3次元分類 | クラス数: 200 / ソフトウェア - 名称: cryoSPARC (ver. 3.3.2) |
| 最終 角度割当 | タイプ: OTHER |
| 最終 再構成 | 使用したクラス数: 93 / 想定した対称性 - 点群: C7 (7回回転対称 ) / 解像度のタイプ: BY AUTHOR / 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC (ver. 3.3.2) / 使用した粒子像数: 89373 ) / 解像度のタイプ: BY AUTHOR / 解像度: 3.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC (ver. 3.3.2) / 使用した粒子像数: 89373 |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-8emc: |
 ムービー
ムービー コントローラー
コントローラー






 Z
Z Y
Y X
X