+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of Rous sarcoma virus strand transfer complex | |||||||||
 マップデータ マップデータ | Flipped map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | intasome / integrase-viral DNA complex /  strand transfer complex (逆転写酵素) / strand transfer complex (逆転写酵素) /  VIRAL PROTEIN-DNA complex (ウイルス性) VIRAL PROTEIN-DNA complex (ウイルス性) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ /  リボヌクレアーゼH / DNA integration / リボヌクレアーゼH / DNA integration /  逆転写酵素 / viral genome integration into host DNA / establishment of integrated proviral latency / 逆転写酵素 / viral genome integration into host DNA / establishment of integrated proviral latency /  RNA-directed DNA polymerase activity / RNA-directed DNA polymerase activity /  転移酵素; リンを含む基を移すもの; 核酸を移すもの / RNA-DNA hybrid ribonuclease activity / viral nucleocapsid ... 転移酵素; リンを含む基を移すもの; 核酸を移すもの / RNA-DNA hybrid ribonuclease activity / viral nucleocapsid ... 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ / 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ /  リボヌクレアーゼH / DNA integration / リボヌクレアーゼH / DNA integration /  逆転写酵素 / viral genome integration into host DNA / establishment of integrated proviral latency / 逆転写酵素 / viral genome integration into host DNA / establishment of integrated proviral latency /  RNA-directed DNA polymerase activity / RNA-directed DNA polymerase activity /  転移酵素; リンを含む基を移すもの; 核酸を移すもの / RNA-DNA hybrid ribonuclease activity / viral nucleocapsid / DNA recombination / 転移酵素; リンを含む基を移すもの; 核酸を移すもの / RNA-DNA hybrid ribonuclease activity / viral nucleocapsid / DNA recombination /  加水分解酵素; エステル加水分解酵素 / 加水分解酵素; エステル加水分解酵素 /  DNAポリメラーゼ / aspartic-type endopeptidase activity / DNAポリメラーゼ / aspartic-type endopeptidase activity /  DNA-directed DNA polymerase activity / symbiont entry into host cell / DNA-directed DNA polymerase activity / symbiont entry into host cell /  タンパク質分解 / タンパク質分解 /  DNA binding / DNA binding /  RNA binding / zinc ion binding RNA binding / zinc ion binding類似検索 - 分子機能 | |||||||||
| 生物種 |   Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) | |||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.36 Å クライオ電子顕微鏡法 / 解像度: 3.36 Å | |||||||||
 データ登録者 データ登録者 | Pandey KK / Bera S / Shi K / Aihara H / Grandgenett DP | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: J Biol Chem / 年: 2023 ジャーナル: J Biol Chem / 年: 2023タイトル: Molecular determinants for Rous sarcoma virus intasome assemblies involved in retroviral integration. 著者: Sibes Bera / Ke Shi / Hideki Aihara / Duane P Grandgenett / Krishan K Pandey /  要旨: Integration of retroviral DNA into the host genome involves the formation of integrase (IN)-DNA complexes termed intasomes. Further characterization of these complexes is needed to understand their ...Integration of retroviral DNA into the host genome involves the formation of integrase (IN)-DNA complexes termed intasomes. Further characterization of these complexes is needed to understand their assembly process. Here, we report the single-particle cryo-EM structure of the Rous sarcoma virus (RSV) strand transfer complex (STC) intasome produced with IN and a preassembled viral/target DNA substrate at 3.36 Å resolution. The conserved intasome core region consisting of IN subunits contributing active sites interacting with viral/target DNA has a resolution of 3 Å. Our structure demonstrated the flexibility of the distal IN subunits relative to the IN subunits in the conserved intasome core, similar to results previously shown with the RSV octameric cleaved synaptic complex intasome produced with IN and viral DNA only. An extensive analysis of higher resolution STC structure helped in the identification of nucleoprotein interactions important for intasome assembly. Using structure-function studies, we determined the mechanisms of several IN-DNA interactions critical for assembly of both RSV intasomes. We determined the role of IN residues R244, Y246, and S124 in cleaved synaptic complex and STC intasome assemblies and their catalytic activities, demonstrating differential effects. Taken together, these studies advance our understanding of different RSV intasome structures and molecular determinants involved in their assembly. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27823.map.gz emd_27823.map.gz | 66.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27823-v30.xml emd-27823-v30.xml emd-27823.xml emd-27823.xml | 20.2 KB 20.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_27823.png emd_27823.png | 76.6 KB | ||
| Filedesc metadata |  emd-27823.cif.gz emd-27823.cif.gz | 6.7 KB | ||
| その他 |  emd_27823_half_map_1.map.gz emd_27823_half_map_1.map.gz emd_27823_half_map_2.map.gz emd_27823_half_map_2.map.gz | 120.1 MB 120.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27823 http://ftp.pdbj.org/pub/emdb/structures/EMD-27823 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27823 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27823 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8e14MC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27823.map.gz / 形式: CCP4 / 大きさ: 129.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27823.map.gz / 形式: CCP4 / 大きさ: 129.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Flipped map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.16 Å | ||||||||||||||||||||
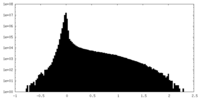
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map A
| ファイル | emd_27823_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
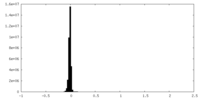
| 密度ヒストグラム |
-ハーフマップ: Half map B
| ファイル | emd_27823_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
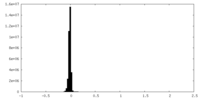
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : RSV strand transfer complex
| 全体 | 名称: RSV strand transfer complex |
|---|---|
| 要素 |
|
-超分子 #1: RSV strand transfer complex
| 超分子 | 名称: RSV strand transfer complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#4 |
|---|---|
| 由来(天然) | 生物種:   Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) |
| 分子量 | 理論値: 257 KDa |
-分子 #1: integrase
| 分子 | 名称: integrase / タイプ: protein_or_peptide / ID: 1 / コピー数: 8 / 光学異性体: LEVO EC番号:  加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ 加水分解酵素; プロテアーゼ; ペプチド結合加水分解酵素; アスパラギン酸プロテアーゼ |
|---|---|
| 由来(天然) | 生物種:   Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) Rous sarcoma virus - Prague C (ラウス肉腫ウイルス)株: Prague C |
| 分子量 | 理論値: 30.926582 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: PLREAKDLHT ALHIGPRALS KACNISMQQA REVVQTCPHC NSAPALEAGV NPRGLGPLQI WQTDFTLEPR MAPRSWLAVT VDTASSAIV VTQHGRVTSV AVQHHWATAI AVLGRPKAIK TDNGSCFTSK STREWLARWG IAHTTGIPGN SQGQAMVERA N RLLKDKIR ...文字列: PLREAKDLHT ALHIGPRALS KACNISMQQA REVVQTCPHC NSAPALEAGV NPRGLGPLQI WQTDFTLEPR MAPRSWLAVT VDTASSAIV VTQHGRVTSV AVQHHWATAI AVLGRPKAIK TDNGSCFTSK STREWLARWG IAHTTGIPGN SQGQAMVERA N RLLKDKIR VLAEGDGFMK RIPTSKQGEL LAKAMYALNH FERGENTKTP IQKHWRPTVL TEGPPVKIRI ETGEWEKGWN VL VWGRGYA AVKNRDTDKV IWVPSRKVKP DITQKDEVTK K UniProtKB: Gag-Pol polyprotein |
-分子 #2: DNA (42-MER)
| 分子 | 名称: DNA (42-MER) / タイプ: dna / ID: 2 / コピー数: 2 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:   Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) |
| 分子量 | 理論値: 13.047456 KDa |
| 配列 | 文字列: (DG)(DA)(DG)(DT)(DA)(DT)(DT)(DG)(DC)(DA) (DT)(DA)(DA)(DG)(DA)(DC)(DA)(DA)(DC)(DA) (DG)(DT)(DG)(DC)(DA)(DC)(DG)(DA)(DA) (DA)(DG)(DA)(DA)(DG)(DA)(DA)(DG)(DA)(DC) (DA) (DC)(DT) |
-分子 #3: DNA (5'-D(*AP*AP*TP*GP*TP*TP*GP*TP*CP*TP*TP*AP*TP*GP*CP*AP*AP*TP*...
| 分子 | 名称: DNA (5'-D(*AP*AP*TP*GP*TP*TP*GP*TP*CP*TP*TP*AP*TP*GP*CP*AP*AP*TP*AP*CP*TP*C)-3') タイプ: dna / ID: 3 / コピー数: 2 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:   Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) |
| 分子量 | 理論値: 6.716363 KDa |
| 配列 | 文字列: (DA)(DA)(DT)(DG)(DT)(DT)(DG)(DT)(DC)(DT) (DT)(DA)(DT)(DG)(DC)(DA)(DA)(DT)(DA)(DC) (DT)(DC) |
-分子 #4: DNA (5'-D(*AP*GP*TP*GP*TP*CP*TP*TP*CP*TP*TP*CP*TP*TP*TP*C)-3')
| 分子 | 名称: DNA (5'-D(*AP*GP*TP*GP*TP*CP*TP*TP*CP*TP*TP*CP*TP*TP*TP*C)-3') タイプ: dna / ID: 4 / コピー数: 2 / 分類: DNA |
|---|---|
| 由来(天然) | 生物種:   Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) Rous sarcoma virus - Prague C (ラウス肉腫ウイルス) |
| 分子量 | 理論値: 4.821123 KDa |
| 配列 | 文字列: (DA)(DG)(DT)(DG)(DT)(DC)(DT)(DT)(DC)(DT) (DT)(DC)(DT)(DT)(DT)(DC) |
-分子 #5: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 5 / コピー数: 2 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.5 mg/mL |
|---|---|
| 緩衝液 | pH: 7.5 |
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 12 / 前処理 - タイプ: PLASMA CLEANING |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 0.01 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 59000 Bright-field microscopy / Cs: 0.01 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 59000 |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 検出モード: SUPER-RESOLUTION / 実像数: 3000 / 平均電子線量: 50.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 1811357 |
|---|---|
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
| 初期 角度割当 | タイプ: NOT APPLICABLE |
| 最終 3次元分類 | クラス数: 5 / 平均メンバー数/クラス: 130000 / ソフトウェア - 名称: cryoSPARC |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.36 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC (ver. 3.1.1) / 使用した粒子像数: 141000 |
 ムービー
ムービー コントローラー
コントローラー





 Z
Z Y
Y X
X