+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-21863 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | SARM1 Autoinhibited Conformation | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | NADase / ARM / SAM / TIR /  HYDROLASE (加水分解酵素) HYDROLASE (加水分解酵素) | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of MyD88-independent toll-like receptor signaling pathway / MyD88-independent TLR4 cascade / Toll Like Receptor 3 (TLR3) Cascade / NAD catabolic process /  NAD+ nucleosidase activity / ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase / protein localization to mitochondrion / NAD+ nucleotidase, cyclic ADP-ribose generating / NADP+ nucleosidase activity / NAD+ nucleosidase activity / ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase / protein localization to mitochondrion / NAD+ nucleotidase, cyclic ADP-ribose generating / NADP+ nucleosidase activity /  nervous system process ...negative regulation of MyD88-independent toll-like receptor signaling pathway / MyD88-independent TLR4 cascade / Toll Like Receptor 3 (TLR3) Cascade / NAD catabolic process / nervous system process ...negative regulation of MyD88-independent toll-like receptor signaling pathway / MyD88-independent TLR4 cascade / Toll Like Receptor 3 (TLR3) Cascade / NAD catabolic process /  NAD+ nucleosidase activity / ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase / protein localization to mitochondrion / NAD+ nucleotidase, cyclic ADP-ribose generating / NADP+ nucleosidase activity / NAD+ nucleosidase activity / ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase / protein localization to mitochondrion / NAD+ nucleotidase, cyclic ADP-ribose generating / NADP+ nucleosidase activity /  nervous system process / nervous system process /  加水分解酵素; 糖加水分解酵素; N-グリコシル化合物加水分解酵素 / regulation of dendrite morphogenesis / response to axon injury / response to glucose / signaling adaptor activity / regulation of neuron apoptotic process / TRAF6-mediated induction of TAK1 complex within TLR4 complex / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / IKK complex recruitment mediated by RIP1 / 加水分解酵素; 糖加水分解酵素; N-グリコシル化合物加水分解酵素 / regulation of dendrite morphogenesis / response to axon injury / response to glucose / signaling adaptor activity / regulation of neuron apoptotic process / TRAF6-mediated induction of TAK1 complex within TLR4 complex / Activation of IRF3, IRF7 mediated by TBK1, IKKε (IKBKE) / IKK complex recruitment mediated by RIP1 /  nervous system development / nervous system development /  微小管 / mitochondrial outer membrane / 微小管 / mitochondrial outer membrane /  細胞分化 / 細胞分化 /  神経繊維 / 神経繊維 /  自然免疫系 / 自然免疫系 /  樹状突起 / 樹状突起 /  シナプス / シナプス /  シグナル伝達 / シグナル伝達 /  ミトコンドリア / identical protein binding / ミトコンドリア / identical protein binding /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
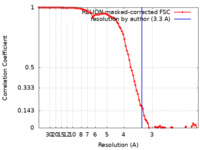
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.3 Å クライオ電子顕微鏡法 / 解像度: 3.3 Å | ||||||||||||
 データ登録者 データ登録者 | Xie T / Bratkowski M | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Cell Rep / 年: 2020 ジャーナル: Cell Rep / 年: 2020タイトル: Structural and Mechanistic Regulation of the Pro-degenerative NAD Hydrolase SARM1. 著者: Matthew Bratkowski / Tian Xie / Desiree A Thayer / Shradha Lad / Prakhyat Mathur / Yu-San Yang / Gregory Danko / Thomas C Burdett / Jean Danao / Aaron Cantor / Jennifer A Kozak / Sean P Brown ...著者: Matthew Bratkowski / Tian Xie / Desiree A Thayer / Shradha Lad / Prakhyat Mathur / Yu-San Yang / Gregory Danko / Thomas C Burdett / Jean Danao / Aaron Cantor / Jennifer A Kozak / Sean P Brown / Xiaochen Bai / Shilpa Sambashivan /  要旨: The NADase SARM1 is a central switch in injury-activated axon degeneration, an early hallmark of many neurological diseases. Here, we present cryo-electron microscopy (cryo-EM) structures of ...The NADase SARM1 is a central switch in injury-activated axon degeneration, an early hallmark of many neurological diseases. Here, we present cryo-electron microscopy (cryo-EM) structures of autoinhibited (3.3 Å) and active SARM1 (6.8 Å) and provide mechanistic insight into the tight regulation of SARM1's function by the local metabolic environment. Although both states retain an octameric core, the defining feature of the autoinhibited state is a lock between the autoinhibitory Armadillo/HEAT motif (ARM) and catalytic Toll/interleukin-1 receptor (TIR) domains, which traps SARM1 in an inactive state. Mutations that break this lock activate SARM1, resulting in catastrophic neuronal death. Notably, the mutants cannot be further activated by the endogenous activator nicotinamide mononucleotide (NMN), and active SARM1 is product inhibited by Nicotinamide (NAM), highlighting SARM1's functional dependence on key metabolites in the NAD salvage pathway. Our studies provide a molecular understanding of SARM1's transition from an autoinhibited to an injury-activated state and lay the foundation for future SARM1-based therapies to treat axonopathies. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_21863.map.gz emd_21863.map.gz | 62.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-21863-v30.xml emd-21863-v30.xml emd-21863.xml emd-21863.xml | 12.7 KB 12.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_21863_fsc.xml emd_21863_fsc.xml | 9.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_21863.png emd_21863.png | 146.1 KB | ||
| Filedesc metadata |  emd-21863.cif.gz emd-21863.cif.gz | 5.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-21863 http://ftp.pdbj.org/pub/emdb/structures/EMD-21863 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21863 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-21863 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_21863.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_21863.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.07 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : SARM1 in an autoinhibited conformation
| 全体 | 名称: SARM1 in an autoinhibited conformation |
|---|---|
| 要素 |
|
-超分子 #1: SARM1 in an autoinhibited conformation
| 超分子 | 名称: SARM1 in an autoinhibited conformation / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: NAD(+) hydrolase SARM1
| 分子 | 名称: NAD(+) hydrolase SARM1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 8 / 光学異性体: LEVO / EC番号: ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 75.679594 KDa |
| 組換発現 | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MGPREVSPGA GTEVQDALER ALPELQQALS ALKQAGGARA VGAGLAEVFQ LVEEAWLLPA VGREVAQGLC DAIRLDGGLD LLLRLLQAP ELETRVQAAR LLEQILVAEN RDRVARIGLG VILNLAKERE PVELARSVAG ILEHMFKHSE ETCQRLVAAG G LDAVLYWC ...文字列: MGPREVSPGA GTEVQDALER ALPELQQALS ALKQAGGARA VGAGLAEVFQ LVEEAWLLPA VGREVAQGLC DAIRLDGGLD LLLRLLQAP ELETRVQAAR LLEQILVAEN RDRVARIGLG VILNLAKERE PVELARSVAG ILEHMFKHSE ETCQRLVAAG G LDAVLYWC RRTDPALLRH CALALGNCAL HGGQAVQRRM VEKRAAEWLF PLAFSKEDEL LRLHACLAVA VLATNKEVER EV ERSGTLA LVEPLVASLD PGRFARCLVD ASDTSQGRGP DDLQRLVPLL DSNRLEAQCI GAFYLCAEAA IKSLQGKTKV FSD IGAIQS LKRLVSYSTN GTKSALAKRA LRLLGEEVPR PILPSVPSWK EAEVQTWLQQ IGFSKYCESF REQQVDGDLL LRLT EEELQ TDLGMKSGIT RKRFFRELTE LKTFANYSTC DRSNLADWLG SLDPRFRQYT YGLVSCGLDR SLLHRVSEQQ LLEDC GIHL GVHRARILTA AREMLHSPLP CTGGKPSGDT PDVFISYRRN SGSQLASLLK VHLQLHGFSV FIDVEKLEAG KFEDKL IQS VMGARNFVLV LSPGALDKCM QDHDCKDWVH KEIVTALSCG KNIVPIIDGF EWPEPQVLPE DMQAVLTFNG IKWSHEY QE ATIEKIIRFL QGRSSRDSSA GSDTSLEGAA PMGPTGGSEN LYFQ UniProtKB: NAD(+) hydrolase SARM1 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 |
|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 90 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 倍率(補正後): 46729 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / Cs: 2.7 mm Bright-field microscopy / Cs: 2.7 mm |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 平均電子線量: 60.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー