+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | 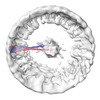 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structural insights into the activation mechanism of antimicrobial GBP1: Polymeric assembly of GBP1 | |||||||||
 マップデータ マップデータ | Guanylate-binding protein 1 polymer | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード |  Oligomer (オリゴマー) / Oligomer (オリゴマー) /  GTPase (GTPアーゼ) / Interferon-induced / GTPase (GTPアーゼ) / Interferon-induced /  ANTIMICROBIAL PROTEIN (抗微生物ペプチド) ANTIMICROBIAL PROTEIN (抗微生物ペプチド) | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報GDP phosphatase activity / non-canonical inflammasome complex assembly / protein localization to vacuole / negative regulation of substrate adhesion-dependent cell spreading / symbiont cell surface /  cytolysis in another organism / positive regulation of pyroptotic inflammatory response / vesicle membrane / negative regulation of protein localization to plasma membrane / negative regulation of interleukin-2 production ...GDP phosphatase activity / non-canonical inflammasome complex assembly / protein localization to vacuole / negative regulation of substrate adhesion-dependent cell spreading / symbiont cell surface / cytolysis in another organism / positive regulation of pyroptotic inflammatory response / vesicle membrane / negative regulation of protein localization to plasma membrane / negative regulation of interleukin-2 production ...GDP phosphatase activity / non-canonical inflammasome complex assembly / protein localization to vacuole / negative regulation of substrate adhesion-dependent cell spreading / symbiont cell surface /  cytolysis in another organism / positive regulation of pyroptotic inflammatory response / vesicle membrane / negative regulation of protein localization to plasma membrane / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway / cytolysis in another organism / positive regulation of pyroptotic inflammatory response / vesicle membrane / negative regulation of protein localization to plasma membrane / negative regulation of interleukin-2 production / negative regulation of T cell receptor signaling pathway /  spectrin binding / spectrin binding /  cytokine binding / defense response to protozoan / cytokine binding / defense response to protozoan /  加水分解酵素; 酸無水物に作用; リン含有酸無水物に作用 / cellular response to interleukin-1 / regulation of protein localization to plasma membrane / regulation of calcium-mediated signaling / G protein activity / 加水分解酵素; 酸無水物に作用; リン含有酸無水物に作用 / cellular response to interleukin-1 / regulation of protein localization to plasma membrane / regulation of calcium-mediated signaling / G protein activity /  lipopolysaccharide binding / lipopolysaccharide binding /  加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 /  Hsp90 protein binding / cytoplasmic vesicle membrane / negative regulation of ERK1 and ERK2 cascade / cellular response to type II interferon / GDP binding / Interferon gamma signaling / Hsp90 protein binding / cytoplasmic vesicle membrane / negative regulation of ERK1 and ERK2 cascade / cellular response to type II interferon / GDP binding / Interferon gamma signaling /  マイクロフィラメント / cellular response to tumor necrosis factor / マイクロフィラメント / cellular response to tumor necrosis factor /  actin binding / cytoplasmic vesicle / defense response to virus / defense response to bacterium / actin binding / cytoplasmic vesicle / defense response to virus / defense response to bacterium /  ゴルジ体 / ゴルジ体 /  自然免疫系 / 自然免疫系 /  GTPase activity / GTP binding / GTPase activity / GTP binding /  ゴルジ体 / ゴルジ体 /  enzyme binding / protein homodimerization activity / extracellular region / identical protein binding / enzyme binding / protein homodimerization activity / extracellular region / identical protein binding /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | |||||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
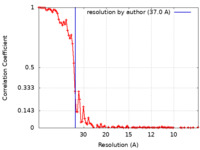
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 37.0 Å クライオ電子顕微鏡法 / 解像度: 37.0 Å | |||||||||
 データ登録者 データ登録者 | Weismehl M / Chu X / Kutsch M / Lauterjung P / Herrmann C / Kudryashev M / Daumke O | |||||||||
| 資金援助 |  ドイツ, 2件 ドイツ, 2件
| |||||||||
 引用 引用 |  ジャーナル: EMBO J / 年: 2024 ジャーナル: EMBO J / 年: 2024タイトル: Structural insights into the activation mechanism of antimicrobial GBP1. 著者: Marius Weismehl / Xiaofeng Chu / Miriam Kutsch / Paul Lauterjung / Christian Herrmann / Misha Kudryashev / Oliver Daumke /   要旨: The dynamin-related human guanylate-binding protein 1 (GBP1) mediates host defenses against microbial pathogens. Upon GTP binding and hydrolysis, auto-inhibited GBP1 monomers dimerize and assemble ...The dynamin-related human guanylate-binding protein 1 (GBP1) mediates host defenses against microbial pathogens. Upon GTP binding and hydrolysis, auto-inhibited GBP1 monomers dimerize and assemble into soluble and membrane-bound oligomers, which are crucial for innate immune responses. How higher-order GBP1 oligomers are built from dimers, and how assembly is coordinated with nucleotide-dependent conformational changes, has remained elusive. Here, we present cryo-electron microscopy-based structural data of soluble and membrane-bound GBP1 oligomers, which show that GBP1 assembles in an outstretched dimeric conformation. We identify a surface-exposed helix in the large GTPase domain that contributes to the oligomerization interface, and we probe its nucleotide- and dimerization-dependent movements that facilitate the formation of an antimicrobial protein coat on a gram-negative bacterial pathogen. Our results reveal a sophisticated activation mechanism for GBP1, in which nucleotide-dependent structural changes coordinate dimerization, oligomerization, and membrane binding to allow encapsulation of pathogens within an antimicrobial protein coat. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_18698.map.gz emd_18698.map.gz | 49.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-18698-v30.xml emd-18698-v30.xml emd-18698.xml emd-18698.xml | 15.1 KB 15.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_18698_fsc.xml emd_18698_fsc.xml | 11.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_18698.png emd_18698.png | 104.5 KB | ||
| Filedesc metadata |  emd-18698.cif.gz emd-18698.cif.gz | 5 KB | ||
| その他 |  emd_18698_half_map_1.map.gz emd_18698_half_map_1.map.gz emd_18698_half_map_2.map.gz emd_18698_half_map_2.map.gz | 49.7 MB 49.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-18698 http://ftp.pdbj.org/pub/emdb/structures/EMD-18698 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18698 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18698 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8r1aC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_18698.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_18698.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Guanylate-binding protein 1 polymer | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 4.24 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_18698_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_18698_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Polymeric assembly of human guanylate-binding protein 1 (GBP1)
| 全体 | 名称: Polymeric assembly of human guanylate-binding protein 1 (GBP1) |
|---|---|
| 要素 |
|
-超分子 #1: Polymeric assembly of human guanylate-binding protein 1 (GBP1)
| 超分子 | 名称: Polymeric assembly of human guanylate-binding protein 1 (GBP1) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all / 詳細: in complex with GDP-AlFx |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Guanylate-binding protein 1
| 分子 | 名称: Guanylate-binding protein 1 / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: MRGSHHHHHH GSASEIHMTG PMCLIENTNG RLMANPEALK ILSAITQPMV VVAIVGLYRT GKSYLMNKLA GKKKGFSLGS TVQSHTKGI WMWCVPHPKK PGHILVLLDT EGLGDVEKGD NQNDSWIFAL AVLLSSTFVY NSIGTINQQA MDQLYYVTEL T HRIRSKSS ...文字列: MRGSHHHHHH GSASEIHMTG PMCLIENTNG RLMANPEALK ILSAITQPMV VVAIVGLYRT GKSYLMNKLA GKKKGFSLGS TVQSHTKGI WMWCVPHPKK PGHILVLLDT EGLGDVEKGD NQNDSWIFAL AVLLSSTFVY NSIGTINQQA MDQLYYVTEL T HRIRSKSS PDENENEVED SADFVSFFPD FVWTLRDFSL DLEADGQPLT PDEYLTYSLK LKKGTSQKDE TFNLPRLCIR KF FPKKKCF VFDRPVHRRK LAQLEKLQDE ELDPEFVQQV ADFCSYIFSN SKTKTLSGGI QVNGPRLESL VLTYVNAISS GDL PCMENA VLALAQIENS AAVQKAIAHY EQQMGQKVQL PTESLQELLD LHRDSEREAI EVFIRSSFKD VDHLFQKELA AQLE KKRDD FCKQNQEASS DRCSGLLQVI FSPLEEEVKA GIYSKPGGYR LFVQKLQDLK KKYYEEPRKG IQAEEILQTY LKSKE SMTD AILQTDQTLT EKEKEIEVER VKAESAQASA KMLQEMQRKN EQMMEQKERS YQEHLKQLTE KMENDRVQLL KEQERT LAL KLQEQEQLLK EGFQKESRIM KNEIQDLQTK MRRRKACTIS UniProtKB: Guanylate-binding protein 1 |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.35 mg/mL |
|---|---|
| 緩衝液 | pH: 7.9 詳細: 50 mM Tris-HCl, 150 mM NaCl, 5 mM MgCl2 (supplemented with 200 uM GDP, 300 uM AlCl3, 10 mM NaF) |
| 凍結 | 凍結剤: ETHANE |
| 詳細 | in complex with GDP-AlFx |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm Bright-field microscopy / 最大 デフォーカス(公称値): 2.0 µm最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 81000 |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 60.6 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





 Z
Z Y
Y X
X