+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Wild type hexamer oxalyl-CoA synthetase (OCS) | ||||||||||||||||||
 マップデータ マップデータ | |||||||||||||||||||
 試料 試料 |
| ||||||||||||||||||
 キーワード キーワード |  Peroxisome (ペルオキシソーム) / Oxalyl-CoA ligase / Peroxisome (ペルオキシソーム) / Oxalyl-CoA ligase /  Oligomer (オリゴマー) / Oligomer (オリゴマー) /  Yeast (酵母) / Yeast (酵母) /  LIGASE (リガーゼ) LIGASE (リガーゼ) | ||||||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 oxalate-CoA ligase / medium-chain fatty acid-CoA ligase activity / oxalate-CoA ligase / medium-chain fatty acid-CoA ligase activity /  oxalate-CoA ligase activity / oxalate catabolic process / peroxisomal membrane / peroxisomal matrix / fatty acid metabolic process / oxalate-CoA ligase activity / oxalate catabolic process / peroxisomal membrane / peroxisomal matrix / fatty acid metabolic process /  mRNA binding / mRNA binding /  ATP binding / ATP binding /  細胞質 細胞質類似検索 - 分子機能 | ||||||||||||||||||
| 生物種 |   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) | ||||||||||||||||||
| 手法 |  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.1 Å クライオ電子顕微鏡法 / 解像度: 3.1 Å | ||||||||||||||||||
 データ登録者 データ登録者 | Lill P / Burgi J / Raunser S / Wilmanns M / Gatsogiannis C | ||||||||||||||||||
| 資金援助 |  ドイツ, 5件 ドイツ, 5件
| ||||||||||||||||||
 引用 引用 |  ジャーナル: Biol Chem / 年: 2023 ジャーナル: Biol Chem / 年: 2023タイトル: Asymmetric horseshoe-like assembly of peroxisomal yeast oxalyl-CoA synthetase. 著者: Jérôme Bürgi / Pascal Lill / Evdokia-Anastasia Giannopoulou / Cy M Jeffries / Grzegorz Chojnowski / Stefan Raunser / Christos Gatsogiannis / Matthias Wilmanns /  要旨: Oxalyl-CoA synthetase from is one of the most abundant peroxisomal proteins in yeast and hence has become a model to study peroxisomal translocation. It contains a C-terminal Peroxisome Targeting ...Oxalyl-CoA synthetase from is one of the most abundant peroxisomal proteins in yeast and hence has become a model to study peroxisomal translocation. It contains a C-terminal Peroxisome Targeting Signal 1, which however is partly dispensable, suggesting additional receptor bindings sites. To unravel any additional features that may contribute to its capacity to be recognized as peroxisomal target, we determined its assembly and overall architecture by an integrated structural biology approach, including X-ray crystallography, single particle cryo-electron microscopy and small angle X-ray scattering. Surprisingly, it assembles into mixture of concentration-dependent dimers, tetramers and hexamers by dimer self-association. Hexameric particles form an unprecedented asymmetric horseshoe-like arrangement, which considerably differs from symmetric hexameric assembly found in many other protein structures. A single mutation within the self-association interface is sufficient to abolish any higher-level oligomerization, resulting in a homogenous dimeric assembly. The small C-terminal domain of yeast Oxalyl-CoA synthetase is connected by a partly flexible hinge with the large N-terminal domain, which provides the sole basis for oligomeric assembly. Our data provide a basis to mechanistically study peroxisomal translocation of this target. | ||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15646.map.gz emd_15646.map.gz | 4.5 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15646-v30.xml emd-15646-v30.xml emd-15646.xml emd-15646.xml | 23.7 KB 23.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_15646.png emd_15646.png | 39.7 KB | ||
| マスクデータ |  emd_15646_msk_1.map emd_15646_msk_1.map | 23 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-15646.cif.gz emd-15646.cif.gz | 6.7 KB | ||
| その他 |  emd_15646_additional_1.map.gz emd_15646_additional_1.map.gz emd_15646_additional_2.map.gz emd_15646_additional_2.map.gz emd_15646_half_map_1.map.gz emd_15646_half_map_1.map.gz emd_15646_half_map_2.map.gz emd_15646_half_map_2.map.gz | 1.7 MB 10.3 MB 12.1 MB 11.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15646 http://ftp.pdbj.org/pub/emdb/structures/EMD-15646 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15646 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15646 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8atdMC  8affC  8afgC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15646.map.gz / 形式: CCP4 / 大きさ: 23 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15646.map.gz / 形式: CCP4 / 大きさ: 23 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.09 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_15646_msk_1.map emd_15646_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
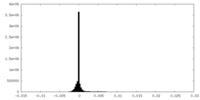
| 密度ヒストグラム |
-追加マップ: #2
| ファイル | emd_15646_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
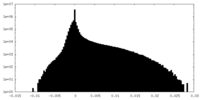
| 密度ヒストグラム |
-追加マップ: #1
| ファイル | emd_15646_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_15646_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_15646_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Hexameric complex of the oxalyl-CoA synthetase Pcs60p
| 全体 | 名称: Hexameric complex of the oxalyl-CoA synthetase Pcs60p |
|---|---|
| 要素 |
|
-超分子 #1: Hexameric complex of the oxalyl-CoA synthetase Pcs60p
| 超分子 | 名称: Hexameric complex of the oxalyl-CoA synthetase Pcs60p タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Saccharomyces cerevisiae (パン酵母) Saccharomyces cerevisiae (パン酵母) |
| 分子量 | 理論値: 360 KDa |
-分子 #1: Oxalate--CoA ligase
| 分子 | 名称: Oxalate--CoA ligase / タイプ: protein_or_peptide / ID: 1 / コピー数: 6 / 光学異性体: LEVO / EC番号:  oxalate-CoA ligase oxalate-CoA ligase |
|---|---|
| 由来(天然) | 生物種:   Saccharomyces cerevisiae (パン酵母) / 株: ATCC 204508 / S288c Saccharomyces cerevisiae (パン酵母) / 株: ATCC 204508 / S288c |
| 分子量 | 理論値: 48.135832 KDa |
| 組換発現 | 生物種:   Escherichia coli (大腸菌) Escherichia coli (大腸菌) |
| 配列 | 文字列: TVTASFNDTF SVSDNVAVIV PETDTQVTYR DLSHMVGHFQ TMFTNPNSPL YGAVFRQDTV AISMRNGLEF IVAFLGATMD AKIGAPLNP NYKEKEFNFY LNDLKSKAIC VPKGTTKLQS SEILKSASTF GCFIVELAFD ATRFRVEYDI YSPEDNYKRV I YRSLNNAK ...文字列: TVTASFNDTF SVSDNVAVIV PETDTQVTYR DLSHMVGHFQ TMFTNPNSPL YGAVFRQDTV AISMRNGLEF IVAFLGATMD AKIGAPLNP NYKEKEFNFY LNDLKSKAIC VPKGTTKLQS SEILKSASTF GCFIVELAFD ATRFRVEYDI YSPEDNYKRV I YRSLNNAK FVNTNPVKFP GFARSSDVAL ILHTSGTTST PKTVPLLHLN IVRSTLNIAN TYKLTPLDRS YVVMPLFHVH GL IGVLLST FRTQGSVVVP DGFHPKLFWD QFVKYNCNWF SCVPTISMIM LNMPKPNPFP HIRFIRSCSS ALAPATFHKL EKE FNAPVL EAYAMTEASH QMTSNNLPPG KRKPGTVGQP QGVTVVILDD NDNVLPPGKV GEVSIRGENV TLGYANNPKA NKEN FTKRE NYFRTGDQGY FDPEGFLVLT GRIKEL UniProtKB: Oxalate--CoA ligase |
-実験情報
-構造解析
| 手法 |  クライオ電子顕微鏡法 クライオ電子顕微鏡法 |
|---|---|
 解析 解析 |  単粒子再構成法 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.3 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 298.15 K / 装置: GATAN CRYOPLUNGE 3 詳細: 90% humidity in the sample chamber. Gentle Blot function, 2.5 seconds. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 最大 デフォーカス(補正後): 2.2 µm 最小 デフォーカス(補正後): 0.7000000000000001 µm 倍率(補正後): 105000 / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD  Bright-field microscopy / Cs: 0.01 mm / 最大 デフォーカス(公称値): 2.2 µm Bright-field microscopy / Cs: 0.01 mm / 最大 デフォーカス(公称値): 2.2 µm最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 105000 |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 検出モード: COUNTING / デジタル化 - 画像ごとのフレーム数: 2-60 / 撮影したグリッド数: 4 / 実像数: 5594 / 平均電子線量: 63.0 e/Å2 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 粒子像選択 | 選択した数: 4000000 / 詳細: Picking was performed using cryOLO |
|---|---|
| 初期モデル | モデルのタイプ: INSILICO MODEL In silico モデル: Initial model was computed from 2D classes using VIPER (SPHIRE Package) |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: SPHIRE (ver. 1.2) / ソフトウェア - 詳細: VIPER |
| 最終 角度割当 | タイプ: OTHER / ソフトウェア - 名称: SPHIRE (ver. 1.3) / ソフトウェア - 詳細: Meridien |
| 最終 再構成 | 想定した対称性 - 点群: C2 (2回回転対称 ) / アルゴリズム: FOURIER SPACE / 解像度のタイプ: BY AUTHOR / 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: SPHIRE (ver. 1.3) / ソフトウェア - 詳細: Post Refinement / 使用した粒子像数: 819000 ) / アルゴリズム: FOURIER SPACE / 解像度のタイプ: BY AUTHOR / 解像度: 3.1 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: SPHIRE (ver. 1.3) / ソフトウェア - 詳細: Post Refinement / 使用した粒子像数: 819000 |
 ムービー
ムービー コントローラー
コントローラー




 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)